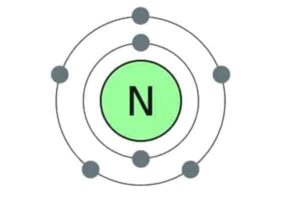
नाइट्रोजन एवं इसके यौगिक के भौतिक एवं रासायनिक गुणधर्म
नाइट्रोजन (Nitrogen) यह आवर्त सारणी के p-ब्लॉक के 15 वें वर्ग का प्रथम तत्व है। इसकी परमाणु संख्या 7 तथा … Continue reading नाइट्रोजन एवं इसके यौगिक के भौतिक एवं रासायनिक गुणधर्म
0 Comments