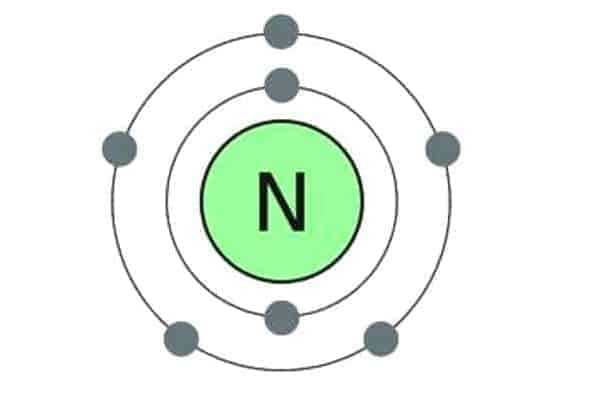
नाइट्रोजन (Nitrogen)
यह आवर्त सारणी के p-ब्लॉक के 15 वें वर्ग का प्रथम तत्व है। इसकी परमाणु संख्या 7 तथा द्रव्यमान 14 होता है।
नाइट्रोजन की खोज (Discovery of Nitrogen)
नाइट्रेट की खोज सर्वप्रथम सन 1772 में स्काटलैंड के प्रसिद्ध रसायनज्ञ डेनियल रदरफोर्ड ने की थी।
प्रारम्भ में नाइट्रोजन का नाम एजोट रखा गया। नाइटर (KNO3) का एक आवश्यक अवयवी तत्व होने के कारण इसका नाम नाइट्रोजन चेपटल नामक वैज्ञानिक ने रखा।
नाइट्रोजन प्रकृति में मुक्त एंव संयुक्त दोनों अवस्थाओं में पाई जाती है। वायुमण्डल मुक्त नाइट्रोजन का अपार भंडार है। यह वायुमण्डल में सर्वाधिक मात्रा (लगभग 78.06%) में पायी जाती है।
संयुक्त अवस्था में यह नाइट्रेट के रूप में साल्टपीटर (NaNO3) तथा शोरे (KNO3) में पाई जाती है।
उपजाऊ भूमि में नाइट्रोजन अमोनियम लवणों (NH4NO2, तथा NH4NO3) के रूप में पाई जाती है।
नाइट्रोजन की प्राप्ति (Extraction of Nitrogen)
(1) प्रयोगशाला विधि (Laboratory Method)
एक गोल पेंदे वाले फ्लास्क में नौसादर (NH4Cl) और सोडियम नाइट्राइट (NaNO2) को मिलाकर धीरे-धीरे गर्म किया जाता है जिससे अमोनियम नाइट्राइट (NH4NO2) बनता है।
NH4Cl + NaNO2 → NH4NO2 + NaCl
अमोनियम नाइट्राइट अपघटित होकर नाइट्रोजन गैस देता है।
NH4NO2 → N2 + 2H2O
(2) लिन्डे विधि द्वारा (By Linde’s process)
नाइट्रोजन प्राप्तकरने की लिन्डे विधि (Linde’s process) में जूल-थामसन प्रभाव (Joule–Thomson effect) द्वारा नाइट्रोजन प्राप्त की जाती है।
जूल-थामसन प्रभाव (Joule–Thomson effect)
इसके अनुसार अधिक दाब (High Pressure) पर किसी गैस को किसी छोटे छिद्र से अचानक कम दाब (Low Pressure) के क्षेत्र में भेजे तो उसका ताप बहुत कम हो जाता है।
अधिक दाब (High Pressure) होने के करण में गैस अणु पास-पास होते जिसके कारण उनके मध्य तीव्र आकर्षण बल (Attraction force) होता है। यदि दाब को अचानक कम कर दिया जाता है तो उस गैस के अणुओं की ऊर्जा अवशोषित (Absorbed) होती है जिससे उनका ताप कम हो जाता है।
यह क्रिया बार-बार दोहराने से वह वायु द्रवित (liquidified) हो जाती है।
विधि इस विधि में वायुमण्डलीय वायु को 200 वायुदाब पर सम्पीडित (Compressed) कर जल प्रशीतक (Water Refigretor) में ठन्डा किया जाता है। फिर इस वायु को निर्वात में एक जेट से गुजारा जाता है।
वायु को बार-बार सम्पीडित (Compressed) कर इस प्रक्रिया को तब तक दोहराया जाता है जब तक वायु द्रवित नहीं हो जाती है।
इस प्रकार प्राप्त द्रवित वायु का प्रभाजी वाष्पन (Affectionate vapor) करके नाइट्रोजन प्राप्त कर ली जाती है। प्रभाजी वाष्पन में नाइट्रोजन ऑक्सीजन से अधिक वाष्पशील होने के कारण पहले प्राप्त होती है।
नाइट्रोजन के भौतिक गुण (Physical Properties of Nitrogen)
- यह रंगहीन एवं गंधहीन गैस है।
- द्रव अवस्था में इसका कवथनांक 77.2K तथा ठोस अवस्था में इसका गलनांक 65K है।
- यह जल में अल्पविलेय है।
नाइट्रोजन के रासायनिक गुण (Chemical Properties of Nitrogen)
- क्रियाशीलता (Reactivity) – यह कम क्रियाशील होती है नाइट्रोजन की रासायनिक अभिक्रियाएँ उच्च ताप व दाब (High temperature and pressure) पर होती हैं।
- ज्वलनशीलता (Flammability) – यह गैस अज्वलनशील है यह स्वंय नहीं जलती और ना ही जलाने में सहायक हैं।
- धातुओं के साथ अभिक्रिया (Reaction with metals) : रक्त तप्त गर्म अवस्था में मैग्नीशियम, एलुमिनियम, लिथियम आदि धातुएँ नाइट्रोजन के साथ अभिक्रिया कर नाइट्राइड (MN2) बनाते हैं।
3Mg + N2 → 2Mg3N2
3Ca + N2 → 2Ca3N2
6Na + N2 → 2Na3N
6K + N2 → 2K3N
2Al + N2 → AlN
6Li + N2 → 2Li3N
- अधातुओं के साथ अभिक्रियाएँ (Reactions with non-metals) –
- नाइट्रोजन, हाइड्रोजन के साथ उच्च दाब तथा 723K से 773K ताप पर अभिक्रिया करके अमोनिया गैस बनती है। इस अभिक्रिया में लोह चुर्ण तथा मलिब्डेनम उत्प्रेरक का कार्य करते है। N2 + H2 → 2NH3 अभिक्रिया उत्क्रमणीय होती हैं।
- नाइट्रोजन, ऑक्सीजन के साथ विद्युत स्फुल्लिंग में अभिक्रिया करके नाइट्रिक ऑक्साइड गैस बनाती है। N2 + O2 → 2NO
- नाइट्रोजन, कार्बन के साथ विद्युत भट्टी में अभिक्रिया करके सायनोजन बनाती है। N2 + C → C2N2
- कैल्सियम कार्बाइड के साथ नाइट्रोजन उच्च ताप पर क्रिया कर कैल्सियम सायनेमाइड या नाइट्रोलिम बनाती हैं। N2 + CaC2 → CaCN2 + C
नाइट्रोजन के उपयोग (Uses of Nitroen)
- यह गैस वायुमण्डल में उपस्थित ऑक्सीजन की सक्रियता (Reactivity) को नियंत्रित (Control) करती है। जिसके कारण वस्तुएँ जलती नहीं रहती।
- इसके यौगिक नाइट्रोजन उर्वरक (Nitrogenous fertilizer) बनाने में काम आते हैं। ये
- बन्द डिब्बों , प्रयोगशाला आदि में निष्क्रिय वातावरण (Passive environment) बनाने में नाइट्रोजन काम आती हैं।
- यह बिजली के बल्बों (Bulbs) तथा उच्च तापमापी यंत्रों में प्रयुक्त की जाती हैं।
नाइट्रोजन का स्थिरीकरण (Fixation of nitrogen )
वायुमण्डल की मुक्त नाइट्रोजन (Free nitrogen) से नाइट्रोजन युक्त यौगिक (Nitrogenous Compound) बनाने की क्रिया “नाइट्रोजन का स्थिरीकरण (Fixation of Nitrogen)” कहलाती हैं।
वायुमण्डल में नाइट्रोजन मुक्त अवस्था (N2) में होती हैं, जबकि विभिन्न नाइट्रोजनीय यौगिकों में उपस्थित नाइट्रोजन संयुक्त अवस्था में होती हैं।
नाइट्रोजन का स्थिरीकरण दो प्रकार से होता है-
- औद्योगिक रूप में
- जैविक रूप में
(i) औद्योगिक नाइट्रोजन स्थिरीकरण
(अ) नाइट्रिक अम्ल का निर्माण
बर्कलैंड आइड विधि द्वारा नाइट्रिक अम्ल का निर्माण किया जाता है। वायु को विद्युत् आर्क में से गुजारने पर नाइट्रोजन (N2) ऑक्सीजन (O2) से संयुक्त होकर नाइट्रिक ऑक्साइड (NO) बनाती है।
N2 + O2 → 2NO
नाइट्रिक ऑक्साइड (NO) ठण्डी होने पर ऑक्सीजन (O2) से मिलकर नाइट्रोजन डाइऑक्साइड (NO2) बनाती हैं।
2NO + O2 → 2NO2
नाइट्रोजन डाइ ऑक्साइड (NO2) को जल में अवशोषित करने पर नाइट्रीक अम्ल बनता (HNO3) है।
2NO2 + H2O → HNO2 + HNO3
(ब) अमोनिया का निर्माण करने में
हैबर विधि (Haber Method) द्वारा अमोनिया का निर्माण किया जाता है।
वायुमण्डलीय नाइट्रोजन का हाइड्रोजन के साथ 1:3 के अनुपात में उच्च दाब व कम ताप पर उत्प्रेरक लोह चुर्ण तथा मोलिब्डेनम की उपस्थिति में संयोग कराने पर अमोनिया का निर्माण होता है।
N2 + H2 → 2NH3
(ii) जैविक रूप में नाइट्रोजन स्थिरीकरण
लेग्युमिनेसी कुल के पादपों (मूंगफली, मटर, चना, सोयाबीन) की जड़ों में गांठे पाई जाती हैं जिनमें सहजीवी जीवाणु (राइजोबियम) पाये जाते हैं। ये जीवाणु (bacteria) वायुमण्डलीय नाइट्रोजन (Atmospheric nitrogen) को सीधे ग्रहण कर नाइट्रोजन के यौगिकों (Nitrogenous Compund) में बदल देते हैं जिन्हें पादप ग्रहण कर लेते हैं।
मिटटी में पाये जाने वाले ऐजोटोबेक्टर (Azotebacter) जीवाणु भी मुक्त नाइट्रोजन ग्रहण करके नाइट्रोजन स्थिरीकरण (Nitrogen Fixation) करते हैं।
ऐसे जीवाणु जिनके द्वारा वायुमण्डलीय नाइट्रोजन का स्थिरीकरण किया जाता हैं, नाइट्रीकारक जीवाणु (nitrifying bacteria) कहलाते हैं।
नाइट्रोजन के यौगिक (Compunds of Nitrogen)
अमोनिया (Ammonia)
इसका निर्माण हैबर द्वारा किया जाता है।
अमोनिया के भौतिक गुण (Physical Properties of Ammonia)
- अमोनिया(Ammonia) रंगहीन, तीखी गन्ध वाली गैस है। इसकी वाष्प से आँखों में आंसू आ जाते हैं।
- यह वायु से हल्की होती है।
- यह जल में अत्यधिक विलेय (Soluble) है। इसका जलीय विलयन (Aqueous solution) लाल लिटमस पत्र को नीला कर देता है, अत:क्षारीय प्रकृति (Alkaline nature) की गैस है।
- द्रवित अमोनिया का क्वथनांक 239.6K होता है। द्रव अमोनिया को ठन्डा करने पर बर्फ जैसे सफेद क्रिस्टल प्राप्त होते हैं जिनका गलनांक 195K होता है।
अमोनिया के रासायनिक गुण (Chemical Properties of Ammonia)
- ज्वलनशीलता (Reactivity) यह न तो स्वंय जलती है और न ही जलाने में सहायक है, परन्तु ऑक्सीजन की उपस्थिति में पीली लौ के साथ जलकर N2 गैस मुक्त करती है।
4NH3 + 3O2 → 2N2 + 6H2O
- अपघटन (Dissociation) अमोनिया विद्युत् स्फुलिंग द्वारा नाइट्रोजन तथा हाइड्रोजन में अपघटित हो जाती है।
4NH3 → N2 + 3H2
- ऑक्सीकरण (Oxidation) गर्म प्लैटिनम तार की उपस्थिति में 1073K ताप पर ऑक्सीजन के साथ क्रिया कर नाइट्रीक ऑक्साइड बनाती है।
4NH3 + 5O2 → 4NO + 6H2O
- हैलोजनों से अभिक्रिया (Reaction with halogen) अमोनिया (NH3),क्लोरीन (Cl2) और आयोडीन (I2) से सान्द्रता के अनुसार दो प्रकार से क्रिया करती है :
- क्लोरीन से अभिक्रिया (Reaction with chlorine)
यदि क्लोरीन की मात्रा कम तथा अमोनिया की अधिकता हो तो अभिक्रिया के फलस्वरूप नौसादर (NH4Cl) एवं नाइट्रोजन (N2) बनती है।
8NH3 + 3Cl2 → 6NH4Cl + 6N2
यदि क्लोरीन (Cl2) की मात्रा अधिक तथा अमोनिया (NH3) कम हो तो नाइट्रोजन ट्राइक्लोराइड (NCl3) बनता है, जो विस्फोटक हैं।
NH3 + 3Cl2 → NCl3 + 3HCl
- आयोडीन के साथ अभिक्रिया (Reaction with iodine)
अमोनिया (NH3), आयोडीन के साथ अभिक्रिया कर नाइट्रोजन ट्राइआयोडाइड (NI3) बनाती है।
NH3 + 3I2 → NI3 + 3HI
नाइट्रोजन ट्राइआयोडाइड (NI3) अमोनिया से संयुक्त होकर अमोनियामय नाइट्रोजन ट्राइआयोडाइड बनाता हैं जो भूरे रंग का होता हैं।
2NH3 + 3I2 → NH3.NI3 + 3HI
दोनों ही पदार्थ NI3 तथा NH3.NI3 प्रबल विस्फोटक हैं।
- क्षार धातुओं के साथ अभिक्रिया (Reaction with Alkali Metals)
द्रव अमोनिया क्षार धातुओं (Alkali Metals) के लिये विलायक (Solvent) का कार्य करता हैं। क्षार धातुएं इसमें घुलकर नीला विलयन बनाती है, जो प्रबल अपचायक (Strong reducing agent) होता हैं।
NH3 + 2Na → NaNH2 + H2
NH3 + 2K → KNH2 + H2
NH3+ Ca → Ca(NH2)2 + H2
गर्म क्षार धातुओं के साथ अभिक्रिया करके ऐमाइड (Amide) बनाती हैं।
- धातु लवण से अभिक्रिया (Reaction with metal salts)
अमोनिया का जलीय विलयन (Aqueous solution) धातु लवण से अभिक्रिया कर उनके हाइड्राक्साइड (MOH) अवक्षेपित करता है।
NaCl + NH4OH → NaOH + NH4Cl
KCl + NH4OH → KOH + NH4Cl
CaCl2 + 2NH4OH → Ca(OH)2 + 2NH4Cl
MnCl2 + 2NH4OH → Mn(OH)2 + 2NH4Cl
AlCl3 + 3NH4OH → Al(OH)3 + 3NH4Cl
FeCl3 + 3NH4OH → Fe(OH)3 + 3NH4Cl
- फोस्जीन से अभिक्रिया
अमोनिया फोस्जीन से अभिक्रिया करके यूरिया बनाती हैं।
COCl2 + NH3 → NH2CONH2 + 2HCl
- अम्लों से साथ अभिक्रिया
सान्द्र HCl के साथ अभिक्रिया कर नौसादर के श्वेत धूम्र बनाती हैं।
NH3 + HCl → NH4Cl
- जटिल यौगिक बनाना
अनेक धातु लवणों से अमोनिया आधिक्य में अभिक्रिया कर विलेय जटिल यौगिक (Complex compound) बनाती हैं।
जैसे कापर सल्फेट को अमोनिया विलयन (NH4OH) में घोलने पर टेट्राऐमिन क्युप्रिक सल्फेट का गहरा नीला विलयन बनता हैं।
CuSO4 + 4NH4OH → [Cu(NH3)4]SO4 + 4H2O
अमोनिया के उपयोग (Uses of Ammonia)
- नाइट्रोजनी उर्वरक (यूरिया, अमोनियम सल्फेट) के निर्माण में।
- बर्फ के कारखानों में प्रशीतक (Refrigerant) के रूप में ।
- ओस्टवाल्ड विधि से नाइट्रीक अम्ल के निर्माण में।
- कपड़ों पर लगे धब्बें व चिकनाई आदि दूर करने के लिए ड्राइ क्लीनिंग (Dry cleaning) में।
- ओषधियों के निर्माण में।
- कृत्रिम रेशम (Artificial silk) बनाने में।
नाइट्रोजन के ऑक्साइड (Oxides of Nitrogen)
नाइट्रोजन (N2) ऑक्सीजन (O2) से संयोग करके निम्न प्रकार के ऑक्साइड (Oxides) बनाती हैं–
(i) नाइट्रस ऑक्साइड (N2O)
(ii) नाइट्रीक ऑक्साइड (NO)
(iii) नाइट्रोजन डाइऑक्साइड (NO2)
(iv) डाइनाइट्रोजन ट्राइऑक्साइड (N2O3)
(v) डाइ नाइट्रोजन टेट्राऑक्साइड (N2O4)
(vi) डाइ नाइट्रोजन पेंटाऑक्साइड (N2O5)
नाइट्रस ऑक्साइड (N2O)
इसे सूंघने से हंसी का आभार होता है, इसलिए इसे हास्य – गैस (laughing gas) भी कहा जाता है।
प्रयोगशाला में नाइट्रस ऑक्साइड अमोनियम सल्फेट ((NH4)2SO4) व सोडियम नाइट्रेट (NaNO3 ) के मिश्रण को गर्म करके बनाई जाती हैं।
NaNO3 + (NH4)2SO4 → 2NH4NO3 + Na2SO4
NH4NO3 → N2O + 2H2O
नाइट्रिक ऑक्साइड (NO)
कॉपर पर तनु नाइट्रिक अम्ल (Dil. HNO3) की क्रिया से नाइट्रिक गैस बनती हैं।
Cu + HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
गैस को फेरस सल्फेट (FeSO4) विलयन में अवशोषित कर तथा प्राप्त गहरे भूरे नाइट्रोसो फेरस सल्फेट (FeSO4.NO) को गर्म करके शुद्ध नाइट्रिक ऑक्साइड (NO) प्राप्त होती हैं।
FeSO4 + NO → FeSO4.NO → FeSO4 + NO
डाइनाइट्रोजन ट्राइऑक्साइड (N2O3)
1:1 के अनुताप में नाइट्रिक डाइऑक्साइड के मिश्रण को 253Kताप पर ठण्डी नली में से प्रवाहित करने पर डाइनाइट्रोजन ट्राइऑक्साइड नीले द्रव के रूप में प्राप्त होता हैं।
NO + NO2 → N2O3
नाइट्रोजन डाइऑक्साइड (NO2) अथवा डाइनाइट्रोजन टेट्राऑक्साइड (N2O4)
प्रयोगशाला में इसे लैड नाइट्रेट [Pb(NO3)2] को गर्म करके बनाया जाता है।
2Pb(NO3)2 → 2PbO + 4NO2 +O2
नाइट्रोजन डाइऑक्साइड (NO2) गैस को हिम मिश्रण (Snow mixture) में रखी U नली में द्रवित करने पर डाइ नाइट्रोजन टेट्राऑक्साइड (N2O4) द्रव के रूप में द्रवित हो जाती हैं।
NO2 → N2O4
डाइ नाइट्रोजन पेन्टाऑक्साइड (N2O5)
यह एक उर्ध्वपाती (Elevation) गुणों वाला ठोस है जिसे 303Kताप पर सान्द्र नाइट्रिक अम्ल (Conc HNO3) को फस्फोरस पेंटऑक्साइड के साथ गर्म करने पर प्राप्त किया जाता हैं।
नाइट्रिक अम्ल (HNO3)
ओस्टवाल्ड विधि (Ostwald Process)
नाइट्रिक अम्ल ओस्टवाल्ड विधि (Ostwald Process) द्वारा प्राप्त किया जाता हैं।
1 आयतन अमोनिया और 8 आयतन वायु का मिश्रण उत्प्रेरक कक्ष में 1073K ताप पर प्लेटिनम की जाली के ऊपर गुजारा जाता है। चूँकि अभिक्रिया ऊष्माक्षेपी (Exothermic) है अत: इस कक्ष में यह ताप बिना गर्म किये स्थायी रहता हैं। यहाँ अमोनिया के उत्प्रेरक आक्सिकरण (Oxidation) से नाइट्रिक ऑक्साइड (NO2) बनती हैं।
4NH3 + 5O2 → 4NO2 + 6H2O
लगभग 90-95% अमोनिया का नाइट्रिक ऑक्साइड में आक्सीकरण हो जाता हैं।
इस प्रकार बनी हुई नाइट्रिक ऑक्साइड को बची हुई ऑक्सीजन के साथ आक्सीकरण कक्ष में भेजा जाता हैं जहाँ वह आक्सीकृत होकर नाइट्रोजन डाइऑक्साइड में बदल जाती हैं।
2NO + O2 → 2NO2
यहाँ से नाइट्रोजन डाइ ऑक्साइड गैस अवशोषक कक्ष (Absorbing chamber) में भेज दी जाती है, जहाँ ऊपर से धीरे-धीरे जल गिरता हैं। जल और नाइट्रोजन डाइऑक्साइड के संयोग से तनु नाइट्रिक अम्ल (Dil. HNO3) है।
2NO2 + H2O → HNO3 + HNO2
3HNO2 → HNO3 + 2NO + H2O
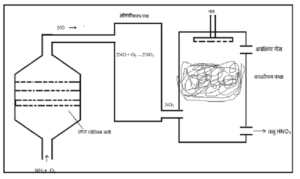
प्राप्त तनु नाइट्रिक अम्ल को जल ऊष्मक पर गर्म कर न्यूनीकृत दाब (redused pressure) पर आसवन करने से लगभग 68% सान्द्र हो जाता है।
अधिक सान्द्र HNO3 प्राप्त करने के लिये अम्ल का सान्द्र H2SO4 के साथ न्यूनीकृत दाब पर आसवन किया जाता है, जिससे लगभग 98% सान्द्र अम्ल प्राप्त हो जाता है। इसे सधूम नाइट्रिक अम्ल कहते हैं।
नाइट्रिक अम्ल के उपयोग (Uses of Nitric Acid)
- उर्वरक बनाने में
- विस्फोटक पदार्थ जैसे – नाइट्रोग्लिसरीन , डाइनेमाइट, टी. एन.टी (ट्राइनाइट्रो टालूईन,Trinitro Taluin ) पिकरिक अम्ल , आदि के निर्माण में
- सोना और चांदी के शोधन में
- रॉकेट ईधन में आक्सीकरक के रूप में
- कृत्रिम रेशम बनाने में







