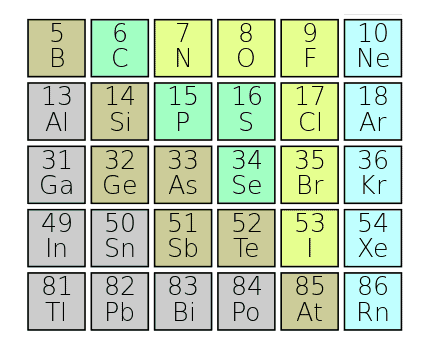
p – ब्लॉक तत्व (p-block elements)
तत्वों के वर्गीकरण की आधुनिक आवर्त सारणी (Modern Periodic table) में 13 से 18 वर्गों में रखे गये तत्वों को p-ब्लांक तत्व (p-block elements) कहते हैं। क्योंकि इन वर्गों के प्रत्येक तत्व के कक्षक का अंतिम इलेक्ट्रॉन p- उपकोश में भरा जाता है।
सामान्य जानकारी (General information)
- प्रत्येक तत्व में प्रवेश करने वाला अंतिम इलेक्ट्रॉन p- उपकोश में जाता है।
- इनका बाह्यतम कोश का सामान्य इलेक्ट्रॉनिक विन्यास ns2,np1-6 होता है।
- हीलियम (2He) में अंतिम इलेक्ट्रॉन 1s उपकोश में जाता है। फिर भी इसे p-ब्लाक तत्वों के साथ 18 वें वर्ग में रखा गया है।
- p- ब्लॉक के तत्वों में धातु, अधातु तथा उपधातु (Metals, non-metals and metalloids) तीनों ही प्रकार के तत्व पाये जाते हैं।
- p ब्लॉक के तत्वों में अधातु तत्वों की संख्या अधिक है।
आवर्त सारणी (Periodic table) के p – खण्ड में कुल छः वर्ग (groups) एवं 30 तत्व (Elements) He सहित 31 है। जो निम्न प्रकार हैं-
धातु (Metals)
- एल्यूमीनियम Aluminium (Al),
- गैलियम Gallium (Ga)
- इण्डीयम Indium (In)
- थैलियम Thallium (Tl)
- टिन Tin (Sn)
- लेड Lead (Pd)
- बिस्मिथ Bismuth (Bi)
अधातु (Non-metals)
- कार्बन Carbon (C)
- नाइट्रोजन Nitrogen (N) – नाइट्रोजन के बारे में अधिक जानकारी के लिए यहाँ click करे
- ऑक्सीजन Oxygen (O)
- फॉस्फोरस Phosphorus (P)
- सल्फर Sulphur(S)
- सेलेनियम Selenium (Se)
हैलोजन (Halogens)
- फ्लोरीन Fluorine (F)
- क्लोरीन Chlorine (Cl)
- ब्रोमीन Bromine (Br)
उपधातु (Metalloids)
- बोरॉन Boron (B) – बोरॉन के बारे में अधिक जानकारी के लिए यहाँ click करे
- सिलिकॉन Silicon (Si)
- जर्मेनियम Germanium (Ge)
- आर्सेनिक Arsenic (As)
- एंटीमनी Antimony (Sb)
- टेल्यूरियम Tellurium (Te)
- पॉलोनियम Polonium (Po)
- एस्टाटिन Astatine (At)
अक्रीय गैसे (Noble Gases)
- हीलियम Helium (He)
- नियॉन Neon (Ne)
- आर्गन Argon (Ar)
- क्रीप्टोन Krypton (Kr)
- जेनोन Xenon (Xe)
- रेडोन Radon (Rn)
p – ब्लॉक तत्वों का इलेक्ट्रॉनिक विन्यास (Electronic configuration of p-block elements)
जैसा की ऊपर बताया जा चूका है कि इनके बाहरी कोश का सामान्य इलेक्ट्रॉनिक विन्यास ns2,np1-6 होता है। अतः अलग-अलग वर्गों का इलेक्ट्रॉनिक विन्यास ns2 निम्न प्रकार होगा-
- वर्ग (Group) 13 ns2 np1
- वर्ग (Group) 14 ns2 np2
- वर्ग (Group) 15 ns2 np3
- वर्ग (Group) 16 ns2 np4
- वर्ग (Group) 17 ns 2 np5
- वर्ग (Group) 18 ns2 np6
p – ब्लॉक तत्वों की समूह ऑक्सीकरण अवस्था (Group oxidation phase of p- block elements)
आधुनिक आवर्त सारणी (Modern Periodic table) में बाएँ से दाएँ जाने पर ऑक्सीकरण अवस्थाएँ बढ़ती है। अतः वर्गों की ऑक्सीकरण अवस्थाएँ
- वर्ग (Group) 13 +3
- वर्ग (Group) 14 +4
- वर्ग (Group) 15 +5
- वर्ग (Group) 16 +6
- वर्ग (Group) 17 +7
- वर्ग (Group) 18 +8
p – ब्लॉक तत्वों की ऑक्सीकरण अवस्थाओं में भिन्नता भी पायी जाती है। अतः से निम्न ऑक्सीकरण अवस्थाएँ भी दर्शाते है-
- वर्ग (Group) 13 +1
- वर्ग (Group) 14 +2, -4
- वर्ग (Group) 15 +3, -3
- वर्ग (Group) 16 +4, +2, -2
- वर्ग (Group) 17 +5, +3, +1, -1
- वर्ग (Group) 18 +6, +4, +2
If you like this post then tell us by comment and share this post on Facebook and Whtsapp.
visit – aliseotools.com/blog







