
periodic table in hindi, Modern periodic table in hindi, Prout’s hypothesis in hindi, Dobereiner’s law of triads, Limitations Dobereiner’s law, Newland’s law of octaves in Hindi, Limitation of Newland’s law, Modern periodic law in hindi, Mendeleev’s Periodic Table in Hindi, Lothar Meyer’s Atomic Volume Curve in Hindi
प्राउट की संकल्पना (Prout’s hypothesis)
प्राउट ने डाल्टन के परमाणुवाद के सिद्धान्त और कुछ तत्वों के परमाणु भार के आधार पर यह संकल्पना की तत्वों के परमाणु भार हाइड्रोजन के परमाणु भार के सरल गुणांक होते है।
प्राउटकी संकल्पना की सीमा (Limitation of Prout’s hypothesis)
तत्वों के परमाणु भार पूर्ण संख्या में न होकर भिन्न में भी पाये जाते।
डोबेराइनर के त्रिक का नियम (Dobereiner’s law of triads)
डोबेराइनर ने तीन-तीन तत्वों के त्रिक बनाएँ।
त्रिक में जब समान गुण वाले तत्वों को उनके परमाणु भार के बढ़ते क्रम में रखा गया।
इनके त्रिक में बीच वाले तत्व का परमाणु भार शेष दोनों तत्वों के परमाणु भार के औसत मान के बराबर (लगभग) होता है।
| Li 7 | Be 8 | |
| Na 23 | Mg 24 | |
| K 39 | Ca 40 |
डोबेराइनर के त्रिक की सीमाएँ (Limitations Dobereiner’s law of triplet)
डोबेराइनर कुछ ही तत्वों को त्रिक के रूप में व्यवस्थित कर सका।
त्रिक में उपस्थित सभी तत्वों का परमाणु भार लगभग समान है। जैसे
| Fe | Ru |
| Co | Rh |
| Ni | Pd |
न्यूलैण्ड का अष्टक नियम (Newland’s law of octaves)
न्यूलैण्ड ने भी तत्वों का वर्गीकरण उनके परमाणु भार के बढ़ते क्रम किया।
अष्टक का नियम के अनुसार जिस प्रकार संगीत के स्वर में 8वाँ स्वर, प्रथम स्वर के समान होता है, उसी प्रकार यदि तत्वों को उनके परमाणु भारों के बढ़ते हुए क्रम में व्यवस्थित किया जाये तो प्रत्येक प्रथम तत्व के पर गुण आठवें तत्व के गुणों से समानता दर्शाते है। जैसे –
| सा | रे | ग | म | प | ध | नि |
| Li | Be | B | C | N | O | F |
| 7 | 9 | 11 | 12 | 14 | 16 | 19 |
| Na | Mg | Al | Si | P | S | Cl |
| 23 | 24 | 27 | 28 | 31 | 32 | 35.5 |
इस सारणी कि लिथियम का आठवाँ तत्व सोडियम है, जिसके गुण लिथियम से मिलते हैं। इसी प्रकार बेरिलियम का आठवें तत्व मैग्नीशियम के गुण, बेरिलियम के गुणों के समान है।
बोरोन का आठवें तत्व एल्युमीनियम के गुण, बोरोन के गुणों के समान है।
न्यूलैण्ड के अष्टक का नियम की सीमाएँ (Limitation of Newland’s law of octaves)
यह वर्गीकरण केवल 14 तत्वों तक ही सीमित रहा किन्तु उत्कृष्ट गैसों की खोज हो जाने पर आठवाँ तत्व उत्कृष्ठ गैस आ जाती है। जो प्रथम तत्व से समानता नहीं रखती।
लोथर मेयर का परमाणु आयतन वक्र (Lothar Meyer’s Atomic Volume Curve)
लोथर मेयर ने तत्वों के भौतिक गुणों को उनके परमाणवीय आयतन से सम्बद्ध किया।
यदि परमाणवीय आयतन को, परमाणु भारों के साथ सम्बद्ध करके ग्राफ खींचे तो उसे लोथर मेयर के आयतन वक्र कहते है।
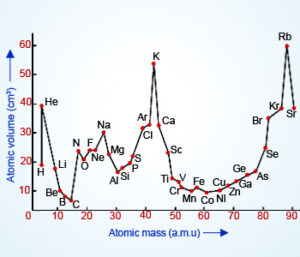
क्षारीय मृदा धातुएँ जो अपेक्षाकृत कुछ कम धनी हैं जैसे Be, Mg Ca, Sr, Ba आदि वक्र के अवरोही भाग में स्थित है।
हैलोजन तथा उत्कृष्ट गैसों (हीलियम के अलावा) ने वक्र के आरोही भाग में स्थान प्राप्त किया।
क्षार धातुओं के आतयन सर्वाधिक होते हैं अतः वक्र में ये शीर्ष स्थान पर पाये गये। ये प्रबल विद्युत धनी तत्व है।
मैण्डेलीफ की आवर्त सारणी (Mendeleev’s Periodic Table)
मैण्डेलीफ का आवर्त नियम (Mandeleev’s Periodic Law)
इसके अनुसार “तत्वों के भौतिक व रासायनिक गुण उनके परमाणु भारों के आवर्ती फलन होते है।”
आवर्ती फलन किसे कहते है? What is a periodic function?
आवर्ती फलन का तात्पर्य यह है, कि यदि तत्वों को बढ़ते हुए परमाणु भार के आधार पर रखा जाये, तो एक निश्चित अन्तराल बाद इनके गुणों में पुनरावृत्ति होती है।
मैण्डेलीफ की आवर्त सारणी की रूपरेखा (Mendeleev’s Periodic Table Profile)
इस आवर्त सारणी में तत्वों को परमाणु भार के बढ़ते हुए क्रम में व्यवस्थित किया गया है।
आवर्त सारणी में क्षैतिज पंक्तियाँ आवर्त तथा लम्बवत् पंक्तियाँ वर्ग कहलाती है।
मैण्डेलीफ की आवर्त सारणी में 7 आवर्त तथा 8 वर्ग है। अक्रिय गैसों का शून्य वर्ग को बाद में जोड़ा गया था। क्योंकि मैण्डेलीफ ने आवर्त सारणी बनाई उस समय अक्रिय गैसों की खोज नहीं हुई थी।
प्रत्येक वर्ग A व B में विभाजित है। (आँठवें व शून्य वर्ग को छोड़कर)
2, 8, 18 व 32 को मेजिक संख्याएँ कहते है।
मैण्डेलीफ की आवर्त सारणी की विशेषताएँ (Mendeleev’s Periodic Table’s Features)
प्रथम बार उस समय तक ज्ञात तत्वों का वर्गीकरण हुआ।
इसके द्वारा नये तत्वों के खोज को भी प्रोत्साहन मिला। मेन्डैलीफ ने उस समय तक अज्ञात तत्वों के गुणों तक की भविष्यवाणी भी कर दी थी। इससे तत्वों को खोजने में बहुत सहायता मिली। इस प्रकार मैण्डेलीफ ने तीन तत्वों की भविष्यवाणी की।
एका-बोरॉन जो बाद में खोजे गये स्कैन्डियम (Sc) के संमान था।
एका-ऐल्युमिनियम जो बाद में खोजे गये गैलियम (Ga) के संमान था।
एका-सिलिकन जो बाद में खोजे गये जर्मेनियम (Ge) के संमान था।
मैण्डेलीफ की आवर्त सारणी की सीमाएँ (Limitation of Mendeleev’s Periodic Table)
हाइड्रोजन का अनिश्चित स्थान द- हाइड्रोजन के गुण क्षार धातु व हैलोजनों दोनों के साथ समानता प्रदर्शित करते हैं। इसको निश्चित नहीं मिला।
समस्थानिकों की व्याख्या – ऐसे तत्व जिनके के परमाणु भार भिन्न-भिन्न परमाणु संख्याँ समान होती समस्थानिक कहलाते हैं।
चूँकि मैण्डेलीफ आवर्त सारणी परमाणु भार पर आधारित है इसलिए विभिन्न समस्थानिकों को भिन्न-भिन्न स्थान मिलने चाहिये।
असमान गुणों वाले को समान स्थान – असमान गुणों वाले तत्व जैसे क्षार धातु के साथ सिक्का धातुएँ Cu, Ag and Au तथा क्षारीय मृदा धातु के साथ Zn, Cd तथा Hg को रखा गया।
तत्वों की संयोजकता पर अधिक ध्यान दिया गया है।
आधुनिक आवर्त सारणी (Modern periodic table)
आधुनिक आवर्त नियम (Modern periodic law)
आधु निक आवर्त नियम के अनुसार ‘‘तत्वों के भौतिक व रासायनिक गुण उनके परमाणु क्रमाकों के आवर्ती फलन होते है।’’
हेनरी मोजले ने यह सिद्ध किया जो कि तेज गति के इलेक्ट्रॉन की धातु पर बौछार कराने पर प्राप्त किरणों की आवृति (v) का वर्गमूल धातु के परमाणु के नाभिकीय आवेश के समानुपाती होता है जिसे निम्नलिखित सम्बन्ध से स्पष्ट किया जा सकता है
√v=a(Z-b)
Z = परमाणु पर नाभिकीय आवेश
a एवं b = स्थिरांक
परमाणु पर नाभिकीय आवेश परमाणु क्रमांक के बराबर होता है।
आधुनिक आवर्त सारणी की विशेषताएँ (Features of Modern periodic table)
आधुनिक आवर्त नियम के आधार पर रेंग व वार्नर ने निर्मित किया तथा बोर द्वारा आवर्त सारणी को दीर्घ स्वरूप दिया गया।

आवर्त सारणी में क्षैतिज रेखाएँ आवर्त (Periods) कहलाती है, जिनकी संख्याँ 7 व लम्बवत रेखाएँ वर्ग (Group) कहलाती है, जिनकी संख्याँ 18 है।
- प्रथम आवर्त में दो तत्व है। यह अति लघु आवर्त कहलाता है।
- दूसरे व तीसरे में 8-8 तत्व है। ये लघु आवर्त कहलाता है।
- चतुर्थ व पंचम में 18-18 तत्व है। ये दीर्घ आवर्त कहलाता है।
- छठे आवर्त में 32 तत्व है, ये अपूर्ण आवर्त है।
- सातवें आवर्त में 19 तत्व है, ये अपूर्ण आवर्त है।
- लैन्थेनाइड -परमाणु क्रमांक 58 से 71 तक के तत्व को छठे आवर्त में गिना जाता है ।
- ऐक्टिनाइड- परमाणु क्रमांक 90 से 103 तक के तत्व को सातवें आवर्त में गिना जाता है।
- यद्यपित इन दोनों आवर्त को आवर्त सारणी के बाहर रखा गया है।
वर्ग (Group)
- प्रथम वर्ग के तत्व क्षार धातुएँ (Alkali Metal) कहलाते है। जैसे H, Li, Na, K, Rb, Cs Fr
- दुसरे वर्ग के तत्व क्षारीय मृदा धातुएँ (Alkali Metal) कहलाते है। जैसे Be, Mg, Ca , Sr, Ba, Ra
- तीसरे वर्ग के तत्व बोरोन परिवार कहलाते है। जैसे B, Al , Ga , In, Tl
- 16 वे वर्ग के तत्व आॅक्सीजन परिवार कहलाते इनको चेल्कोजन भी कहते है। जैसे O, S , Se, Te , Po
- 17 वे वर्ग के तत्व हैलोजन कहलाते है। जैसे F, Cl, Br, I, At
- 18 वे वर्ग के तत्व अक्रिय तत्व, अक्रिय गैस, नोबल गैस कहलाते हैं। He , Ne , Ar, Kr, Xe, Rn
प्रथम आवर्त
प्रथम आवर्त में दो तत्व H तथा He है इसको अति लघु आवर्त कहते है।
दूसरा व तीसरा आवर्त
दूसरे व तीसरे में 8- 8 तत्व है इनको लघु आवर्त कहते है।
दूसरे आवर्त के तत्व Li, Be, B, C, N, O, F तथा Ne है।
तीसरे आवर्त के तत्व Na, Mg, Al, Si, P, S Cl तथा Ar है।
चतुर्थ व पंचम आवर्त
चतुर्थ व पंचम में 18-18 तत्व इसको दीर्घ आवर्त कहते है।
चौथे आवर्त के तत्व पोटैशियम (K), कैल्शियम (Ca), स्कैंडियम (Sc), टाइटेनियम (Ti), वैनेडियम (V), क्रोमियम (Cr), मैंगनीज (Mn), लोहा (Fe), कोबाल्ट (Co), निकल (Ni), तांबा (Cu), जस्ता (Zn), गैलियम (Ge)
जर्मेनियम (Ge), आर्सेनिक (As) सेलेनियम (Se), ब्रोमिन (Br), तथा क्रीप्टोन (Kr) है।
पाँचवे आवर्त के तत्व रुबिडियम (Rb), स्ट्रोंशियम (Sr), यट्रियम (Y), ज़िरकोनियम (Zr), नाइओबियम (Nb), मोलिब्डेनम (Mo), टेक्नेटियम (Tc), रुथेनियम (Ru), रोडियम (Rh), पैलेडियम (Pd), सिल्वर (Ag), कैडमियम (Cd), इन्डियम (In), टिन (Sn) एंटीमनी (Sb), टेल्यूरियम (Te), आयोडीन (I) तथा जिनोन (Xe) है।
छठा आवर्त
छठे आवर्त को अति दीर्घ आवर्त कहते है। इसमें 32 तत्व है। जो सीजियम (Cs), बेरियम (Ba), ल्युटेटियम (Lu), हाफनियम (Hf), टैंटलम (Ta), टंगस्टन (W), रेनीयम (Re), ऑस्मियम (Os), इरीडियम (Ir), प्लेटिनम (Pt), गोल्ड (Au), मर्करी (Hg), थेलियम (Tl), लेड (Pb), बिस्मिथ (Bi), पॉलोनियम (Po), अस्टेटिन (At), तथा रेडोन (Rn) है। बाकि
लेन्थेनाइड तत्व है जो लेन्थेनम (La), सेरियम (Ce), प्रेसोडीमियम (Pr), निओडीनियम (Nd)
प्रोमेथियम (Pm) सेमेरियम (Sm), युरोपियम (Eu), गडोलिनियम (Gd), टेरबियम (Tb), डाइस्प्रोसियम (Dy), होल्मियम (Ho), एर्बियम (Er), थुलियम (Tm), यटटेर्बियम (Yb) है।
सातवा आवर्त
सातवें आवर्त अपूर्ण आवर्त कहते है, इसमें 19 या 32 तत्व है। जो निम्न है-
Francium (Fr)
Radium (Ra)
Lawrencium (Lr)
Rutherfordium (Rf)
Dubnium (Db)
Seaborgium (Sg)
Bohrium (Bh)
Hassium (Hs)
Meitnerium (Mt)
Darmstadtium (Ds)
Roentgenium (Rg)
Copernicium (Cn)
Nihonium (Nh)
Flerovium (Fl)
Moscovium (Mc)
Livermorium (Lv)
Tennessine (Ts)
Oganesson (Og)
Actinium (Ac)
Thorium (Th)
Protactinium (Pa)
Uranium (U)
Neptunium (Np)
Plutonium (Pu)
Americium (Am)
Curium (Cm)
Berkelium (Bk)
Californium (Cf)
Einsteinium (Es)
Fermium (Fm)
Mendelevium (Md)
Nobelium (No)
अभी तक कुल 109 तत्व खोज लिये गये हैं, परन्तु 105 तक के तत्वों का विस्तृत अध्ययन हो पाया है।
periodic table in hindi, Modern periodic table in hindi, Prout’s hypothesis in hindi, Dobereiner’s law of triads, Limitations Dobereiner’s law, Newland’s law of octaves in Hindi, Limitation of Newland’s law, Modern periodic law in hindi, Mendeleev’s Periodic Table in Hindi, Lothar Meyer’s Atomic Volume Curve in Hindi
इन्हें भी पढ़े
रासायनिक अभिक्रिया के प्रकार (Types of Chemical Reaction)
रसायन विज्ञान की कुछ मूल अवधरणाएँ (Some Basic Concepts of Chemistry)
अम्ल क्षारक एवं लवण परिभाषा एवं गुणधर्म (Acid, Base and Salt)
p – ब्लॉक तत्व (p – block element)
बाहरी कड़ियाँ
Our YouTube Channel – Aliscience







Bahut hi informative Post, Aise hi logo ke useful info share karte rahiye.