रसायन विज्ञान की कुछ मूल अवधरणाएँ (Some Concepts Of Chemistry)
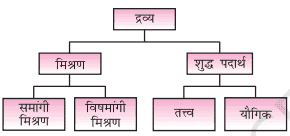
द्रव्य का वर्गीकरण (Classification of matter)
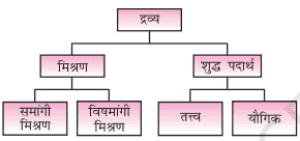
तत्व (Elements)
यदि किसी अणु या परमाणु में सभी कण एक प्रकार के ही होते हैं, तो वह तत्व कहलाता है।
यौगिक (Compound)
दो या दो से अधिक तत्वों के परमाणुओं के निश्चित अनुपात में जुड़ने पर यौगिकों का निर्माण होता है।
जैसे जल (H2O), नमक (NaCl)
मिश्रण (Mixture)
दो या दो से अधिक पदार्थों को मिलाने पर मिश्रण बनता है। जैसे शरबत, नमक का घोल
मात्रक एवं राशियां (Units and quantities)
तत्वों के गुणधर्म को प्रदर्शित करने के लिए मात्रकों की आवश्यकता होती है। जिनमें राशियों को व्यक्त किया जाता है। मात्रक मापन के लिए तीन प्रकार की मापक पद्धतियां होती है-
(1) SI या अन्तर्राष्ट्रीय पद्धति (International System of Units और Système International d’Unités)
(2) मीटर परिपाटी (conference Generale des Poios et Measures, CGPM)
(3) फूट परिपाटी
इनको संक्षेप में निम्न प्रकार दर्शाते है-
- C.G.S. इकाई का मतलब सेंटीमीटर, ग्राम, सेकंड है।
- M.K.S. इकाई का मतलब मीटर, किलोग्राम, सेकंड है।
- F.P.S. इकाई का मतलब फुट, पाउंड, सेकंड है।
इकाईयों को दो भागों में बाँटते है-
(i) मौलिक इकाई (Fundamental unit)
ये मापन की मूल इकाई होती है। जैसे –
| भौतिक राशि | प्रतिक | मात्रक | प्रतिक |
| लम्बाई | l | मीटर | m |
| द्रव्यमान | m | किलोग्राम | Kg |
| समय | t | सेकंड | s |
| विद्युत धारा | I | एम्पीयर | A |
| तापमान | T | केल्विन | K |
| प्रदार्थ की मात्रा | n | मोल | mol |
| प्रकाश की तीव्रता | Io | केन्डला | cd |
(ii) व्युत्पन्न इकाई (Derived unit)
इनकी उत्पत्ति मूल इकाइयों से होती है जैसे
आयतन (Volume)
किसी पदार्थ द्वारा घेरे हुए स्थान को आयतन कहते हैं। आयतन के मात्रक (लम्बाई)3 में होते हैं। अतः SI पद्धति में आयतन का मात्रक m3 होता है, इसको मापने के लिए सिलींडर, ब्यूरेट, पिपेट आदि का उपयोग किया जाता है।
घनत्व (The density)
किसी पदार्थ का घनत्व उसके प्रति इकाई आयतन का द्रव्यमान होता है।

अतः घनत्व के मात्रक इस प्रकार प्राप्त किए जा सकते हैं

नोट – भार तथा द्रव्यमान में अंतर
- किसी पदार्थ का द्रव्यमान उसमें उपस्थित द्रव्य की मात्रा है, जबकि किसी वस्तु का भार उसपर लगनेवाला गुरुत्व बल है।
- किसी पदार्थ का द्रव्यमान स्थिर होता है, परंतु उसका भार गुरुत्व में परिवर्तन के कारण एक स्थान से दूसरे स्थान पर अलग-अलग हो सकता है।
डिग्री सेल्सियस को डिग्री फारेनहाइट में निम्न प्रकार बदलते है-
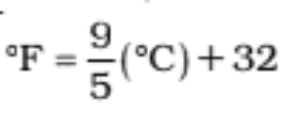
डिग्री सेल्सियस को केल्विन में निम्न प्रकार बदलते है-
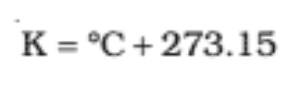
विमीय विश्लेषण (Dimensional analysis)
मापी गई राशियों को मात्रकों की एक पद्धति से दूसरी पद्धति में परिवर्तित करना विमीय विश्लेषण कहलाता है इसको इकाई गुण विधि (unit factor method) या गुणक लेबल विधि (factor label method भी कहते है। जैसे कि मीटर को फुट में प्रदर्शित करना, ग्राम को पौंड में दर्शाना,
परिशुद्धता (Precision)
किसी मापन को बार-बार दोहरा कर प्राप्त किया गया समरूप परिणाम परिशुद्धता कहलाता है।
यथार्थता (Accuracy)
किसी मापन से प्राप्त परिमाण का वास्तविक मान ही यथार्थता कहलाती है।
सार्थक अंक (Significant Figure)
जब किसी मापन का परिणाम शुद्ध रूप से प्राप्त हो तो माप करने के लिए अर्थपूर्ण अंकों की संख्या को सार्थक अंक कहते हैं
- सभी गैर-शून्य अंक सार्थक होते हैं। उदाहरण के लिए 285m में तीन सार्थक अंक और 0.25ml में दो सार्थक अंक हैं।
- प्रथम गैर-शून्य अंक से पहले आने वाले शून्य सार्थक नहीं होते। ऐसे शून्य केवल दशमलव की स्थिति को बताते हैं। अतः 0.03 में केवल एक सार्थक अंक और 0.0052 में दो सार्थक अंक हैं।
- दो गैर-शून्य अंकों के मध्य स्थित शून्य सार्थक होते हैं। अतः 2.005 में चार सार्थक अंक हैं।
- किसी अंक के दशमलव के दाईं ओर या अंत में आने वाले शून्य सार्थक होते हैं, उदाहरण के लिए 0.200 में तीन सार्थक अंक हैं।
- दशमलव विहीन संख्याओं में दाईं ओर के शून्य सार्थक नहीं होते। उदाहरण के लिए 100 में केवल एक सार्थक अंक है।
- 100. में तीन सार्थक अंक है तथा 100.0 में चार सार्थक अंक है।
- 4.01 × 102 में तीन और 8.256 × 10-3 में चार सार्थक अंक हैं।
- वस्तुओं की गिनती, उदाहरण के लिए 2 गेंदों या 20 अंडों में सार्थक अंकों की संख्या अनंत है, क्योंकि ये दोनों ही यथार्थपरक संख्याएँ हैं और इन्हें दशमलव लिखकर उसके बाद अनंत शून्य लिखकर व्यक्त किया जा सकता है।
रसायन विज्ञान की कुछ मूल अवधरणाएँ
रासायनिक संयोजन के नियम (LAWS OF CHEMICAL COMBINATIONS)
- द्रव्यमान संरक्षण का नियम
- स्थिर अनुपात का नियम
- गुणित अनुपात का नियम
- गै लुसैक का गैसीय आयतनों का नियम
- आवोगाद्रो का नियम
द्रव्यमान संरक्षण का नियम (Law of Conservation of Mass)
आंतोएन लावूसिए के अनुसार द्रव्य को ना तो बनाया जा सकता है। और ना ही नष्ट किया जा सकता है। इसी कारण से अभिक्रिया में भाग लेने वाले तत्व तथा अभिक्रिया के पश्चात बनने वाले तत्वों का द्रव्यमान समान होता है
जैसे
2H2 + O2 → 2H2O
2×2 + 16×2 = 2x(2+16)
4 + 32 = 36
36=36
स्थिर अनुपात का नियम (Law of Definite Proportions)
जोसेफ प्राउस्ट के अनुसार किसी यौगिक में तत्वों के द्रव्यमानों का अनुपात सदैव समान रहता है। इसको ‘निश्चित संघटन का नियम’ भी कहा जाता है।
गुणित अनुपात का नियम (Law of Multiple Proportions)
डाल्टन के अनुसार जब दो तत्व संयोजक होकर एक से अधिक यौगिक बनाते हैं तो एक तत्व के साथ दूसरे तत्व के संयुक्त होने पर द्रव्यमान छोटे पूर्णांकों के अनुपात में होते हैं।
उदाहरण के लिए, हाइड्रोजन, ऑक्सीजन के साथ संयुक्त दो यौगिक पानी और हाइड्रोजन परआॅक्साइड बनाता है तो
हाइड्रोजन, ऑक्सीजन → पानी
(2g) + (16g) 18(g)
हाइड्रोजन, ऑक्सीजन → हाइड्रोजन परआॅक्साइड
(2g) + (32g) 34(g)
ऑक्सीजन का द्रव्यमान क्रमशः 16g और 32g जो हाइड्रोजन के 2g द्रव्यमान के साथ संयुक्त होते हैं, जो की एक सरल अनुपात 16:32 या 1:2 में होते हैं।
गै लुसैक का गैसीय आयतनों का नियम (Gay Lussac’s Law of Gaseous Volumes)
जब रसायनिक अभिक्रिया में गैस आपस में संयुक्त होती है, तो उनके आयतन सरल अनुपात में होते हैं जब तापमान व दाब समान हो।
हाइड्रोजन के 100 mL ऑक्सीजन के 50mL के साथ संयुक्त होकर 100mL जल-वाष्प देते हैं। तो
हाइड्रोजन + ऑक्सीजन → जल
100mL 50mL 100mL
अतः हाइड्रोजन और ऑक्सीजन के आयतन सरल अनुपात 2:1 (100mL और 50mL) में होते हैं।
आवोगाद्रो का नियम (Avogadro’s Law)
समान ताप व दाब पर गैसों के समान आयतन में अणुओं की संख्या समान रहती है। आवोगाद्रो संख्या एक मोल पदार्थ में उपस्थित कणों की संख्या को आवोगाद्रो संख्या कहते हैं, इसका मान 6.022 X 1023 होता है।
परमाणु द्रव्यमान (Atomic Mass)
किसी तत्व का परमाणु द्रव्यमान मात्रक को एक कार्बन-12 परमाणु के द्रव्यमान के 1/12 वें भाग के समान होता है। इसे द्रव्यमान स्पेक्टंममिति (mass spectrometry) द्वारा ज्ञात किया जाता है।
आणविक द्रव्यमान (Molecular Mass)
किसी अणु का आणविक द्रव्यमान उसमें उपस्थित विभिन्न तत्वों के परमाणु द्रव्यमान का योग होता है।
जैसे मेथैन (CH4) का आण्विक द्रव्यमान
= 12.011u + 4 (1.008u) = 16.043u
सूत्र द्रव्यमान (Formula Mass)
वे पदार्थ जिनमें अलग-अलग अणु नहीं होते उनमें आणविक द्रव्यमान के स्थान पर सूत्र द्रव्यमान प्रयुक्त होता है।
सोडियम क्लोराइड का सूत्र द्रव्यमान
= सोडियम का परमाणु द्रव्यमान + क्लोरीन का परमाणु द्रव्यमान
= 23.0 u + 35.5 u = 58.5 u
मोल संकल्पना (MOLE CONCEPT)
किसी पदार्थ का एक मोल वह मात्रा है, जिसमें उतने ही कण उपस्थित हो, जितने carbon-12 के समस्थानिक के ठीक 12 ग्राम में परमाणु की संख्या होती है।
कार्बन -12 परमाणु का द्रव्यमान एक द्रव्यमान स्पेक्ट्रोमीटर द्वारा निर्धारित किया गया था जो 1.992648 × 10–23g के बराबर पाया गया। कार्बन के 12 ग्राम में परमाणुओं की संख्या
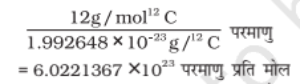
1 मोल में कणों की संख्याँ को आवोगाद्रो संख्या कहते हैं, इसका मान 6.022 X 1023 होता है।
जल के 1 मोल में उपस्थित हाइड्रोजन तथा ऑक्सीजन के अणुओं की संख्याँ ज्ञात कीजिए
1 मोल में हाइड्रोजन के अणुओं की संख्याँ = 6.022 X 1023
एक जल के अणु में 2 अणु हाइड्रोजन के होते है अतः = 2(6.022 X 1023) अणु
1 मोल में ऑक्सीजन के अणुओं की संख्याँ = 6.022 X 1023
रसायन विज्ञान की कुछ मूल अवधरणाएँ
मोलर द्रव्यमान (MOLAR MASSES)
किसी पदार्थ के एक मोल को ग्राम में व्यक्त करने पर प्राप्त द्रव्यमान को मोलर द्रव्यमान कहते है।
पानी का मोलर द्रव्यमान = 18.02g mol–1
सोडियम क्लोराइड का मोलर द्रव्यमान = 58.5g mol–1
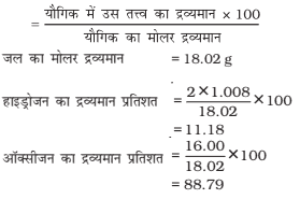
प्रतिशत संगठन (PERCENTAGE COMPOSITION)
किसी यौगिक में उपस्थित तत्वों की प्रतिशत मात्रा को प्रतिशत संगठन कहते है।
पानी में हाइड्रोजन और ऑक्सीजन होता है, इन दोनों तत्वों की प्रतिशत संरचना की गणना निम्नानुसार की जा सकती है:
मूलानुपाती सूत्र (empirical formula)
किसी यौगिक में उपस्थित विभिन्न परमाणुओं के सरलतम पूर्ण संख्या अनुपात को मुलानुपाती सूत्र कहते है।
आणविक सूत्र (molecular formula)
किसी यौगिक के अणु में उपस्थित विभिन्न प्रकार के परमाणुओं की सही संख्या को दर्शाने वाले सूत्र को आणविक सूत्र कहते है।
जैसे ग्लूकोज को मूलानुपाती सूत्र CH2O तथा आणविक सूत्र C6H12O6 होता है।
स्टॉइकियोमीट्री (STOICHIOMETRY)
किसी रासायनिक अभिक्रिया के संतुलित समीकरण को ही स्टॉइकियोमीट्री कहते हैं
सीमांत अभिकर्मक (Limiting Reagent)
किसी संतुलित अभिक्रिया के अनुसार जब एक अभिकर्मक दूसरे के सापेक्ष कम मात्रा में होता है। तो उस कम मात्र वाले अभिकर्मक के समाप्त होते ही अभिक्रिया रुक जाती है। इसे सीमांत अभिकर्मक कहते है।
रसायन विज्ञान की कुछ मूल अवधरणाएँ
विलयन की सांद्रता (Concentration of Solution)
विलयन की सांद्रता को निम्नलिखित रूप में व्यक्त करते हैं।
- द्रव्यमान प्रतिशत
- मोल अंश
- मोलरता
- मोललता
द्रव्यमान प्रतिशत (Mass per cent)
किसी विलयन में उपस्थित विलेय के द्रव्यमान की प्रतिशत मात्रा द्रव्यमान प्रतिशत कहते है।

मोल अंश (Mole Fraction)
किसी मिश्रण या विलयन में किसी घटक के मोलों की संख्या तथा विलियन के मोलों की कुल संख्या के अनुपात को उस घटक का मोल अंश से कहते हैं।
यदि किसी विलियन में A तथा B होतो

मोलरता (Molarity)
1 लीटर विलेन में उपस्थित विलय के मोलो की संख्या को मोलरता कहते हैं।

मोललता (Molality)
एक किलोग्राम विलायक में उपस्थित विलय के मोलो की संख्या को मोललता कहते हैं।

NCERT पुस्तक
[pdf-light-viewer id="14978"]
ऑनलाइन टेस्ट
[wp_quiz_pro id=”14969″]
लेक्चर वीडियो
.











