अम्ल क्षारक एवं लवण
अम्ल एवं क्षारक की परिभाषा (Definitions of Acid and Base)
आरेनियस के अनुसार (According to Arrhenius)
वे पदार्थ जो जलीय विलियन में H+ आयन देते हैं अम्ल कहलाता है। वे रसायनिक पदार्थ जो जलीय विलियन में OH- आयन देते हैं क्षारक कहलाते हैं।
लुईस के अनुसार (According to lewis)
वे रासायनिक पदार्थ जो इलेक्ट्रॉन ग्रहण करते हैं, अम्ल होते हैं। और जो इलेक्ट्रॉन दान देते हैं, क्षारक होते हैं।
ब्रोंस्टेड एवं लोरी के अनुसार (According to Bronsted and Lori)
वे पदार्थ जो प्रोटोन दान देते है, अम्ल कहलाते है। तथा जो प्रोटॉन ग्रहण करते हैं, क्षारक कहलाते है।
अम्लों के उदाहरण (Examples of Acids)
- HCl हाइड्रोक्लोरिक अम्ल
- H2SO4 सल्फ्यूरिक अम्ल
- HNO3 नाइट्रिक अम्ल
- H2CO3 कार्बोनिक अम्ल
- CH3COOH एसीटिक अम्ल
- H3PO4 फास्फोरिक अम्ल
क्षारक के उदाहरण (Examples of Bases)
- KOH पोटैशियम हाइड्रोक्साइड
- NaOH सोडियम हाइड्रोक्साइड
- Ca(OH)2 कैल्शियम हाइड्रोक्साइड
- Mg(OH)2 मैग्नीशियम हाइड्रोक्साइड
- Al(OH)3 एल्युमीनियम हाइड्रोक्साइड
वे क्षारक जो जल में घुलनशील होते है क्षार (Alkali) कहलाते है।
अम्ल के भौतिक गुणधर्म (Physical Properties of Acids)
- ये स्वाद में खट्टे होते है।
- यह जलीय विलियन में H+ आयन देते हैं।
- यह नीले लिटमस पत्र को लाल करते हैं।
- इनका पीएच का मान 7 से कम होता है।
अम्ल के रासायनिक गुणधर्म (Chemical Properties of Acids)
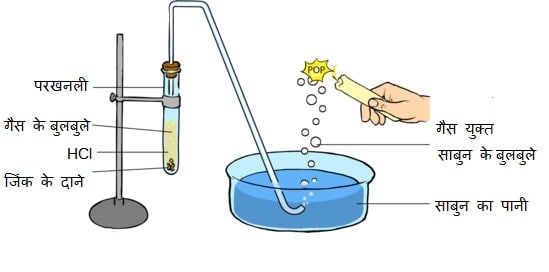
अम्ल धातुओं के साथ अभिक्रिया करके लवण व हाइड्रोजन गैस देता है।
अम्ल + धातु → लवण + हाइड्रोजन गैस
- 2HCl + 2K → 2KCl + H2
- 2HCl + 2Na → 2NaCl + H2
- 2HCl + Ca → CaCl2 + H2
- 2HCl + Mg → MgCl2 + H2
- 6HCl + 2Al → 2AlCl3 + 3H2
- 2HCl + Zn → ZnCl2 + H2
- 2HCl + Fe → FeCl2 + H2
- 2HCl + Pb → PbCl2 + H2
[HCl के स्थान पर H2SO4, HNO3, H2CO3 CH3COOH लेकर अभिक्रिया करवाएं]
Note – उपरोक्त अभिक्रियाओं में निकलने वाली हाइड्रोजन गैस के पास जब जलती हुई मोमबती लेकर जाते है तो वह फट-फट की ध्वनि (पॉप साउंड) उत्पन्न करती है।
अम्ल धातु ऑक्साइड से अभिक्रिया करके लवण तथा जल बनाता है।
- 2HCl + K2O → 2KCl + H2O
- 2HCl + Na2O → 2NaCl + H2O
- 2HCl + CaO → CaCl2 + H2O
- 2HCl + MgO → MgCl2 + H2O
- 6HCl + Al2O3 → 2AlCl3 + 3H2O
- 2HCl + ZnO → ZnCl2 + H2O
- 2HCl + FeO → FeCl2 + H2O
- 2HCl + PbO → PbCl2 + H2O
[HCl के स्थान पर H2SO4, HNO3, H2CO3 CH3COOH लेकर अभिक्रिया करवाएं]
उपरोक्त अभिक्रिया से हमें पता चलता है, कि धातु ऑक्साइड की प्रकृति क्षारकिय होती है।
अम्ल क्षारक से अभिक्रिया करके करके लवण तथा जल का निर्माण करता है।
- HCl + KOH → KCl + H2O
- HCl + NaOH → NaCl + H2O
- 2HCl + Ca(OH)2 → CaCl2 + 2H2O
- 2HCl + Mg(OH)2 → MgCl2 + 2H2O
- 3HCl + Al(OH)3 → AlCl3 + 3H2O
- 2HCl + Zn(OH)2 → ZnCl2 + 2H2O
- 2HCl + Fe(OH)2 → FeCl2 + 2H2O
- 2HCl + Pb(OH)2 → PbCl2 + 2H2O
[HCl के स्थान पर H2SO4, HNO3, H2CO3 CH3COOH लेकर अभिक्रिया करवाएं]
अम्ल के प्राकृतिक स्रोत
| क्रo संo | अम्ल | प्राक्रतिक स्त्रोत |
| 1. | लैक्टिक अम्ल | दही |
| 2. | एसीटिक अम्ल | सिरका |
| 3. | सिट्रिक अम्ल | सन्तरा |
| 4. | टार्टरिक अम्ल | इमली |
| 5. | फार्मिक अम्ल | चींटी-डंक, |
| 6. | आक्सैलिक अम्ल | टमाटर |
| 7. | फार्मिक अम्ल | बिच्छु घास डंक |
क्षारक के भौतिक गुणधर्म (Physical Properties of Base)
- जलीय विलियन में OH– (हाइड्रोक्साइड आयन देते) हैं
- यह लाल लिटमस पत्र को नीला करते हैं।
- यह स्वाद में कड़वे होते हैं।
- यह इनका पीएच का मान 7 से अधिक होता है।
- वे क्षारक जो जल में घुलनशील होते है, क्षार कहलाते है।
क्षारक के रासायनिक गुणधर्म क्षारक (Chemical Properties of Bases)
क्षारक कुछ धातुओं के साथ सभी क्रिया करते हैं
Zn + 2NaOH → Na2ZnO2 + H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
क्षारक कुछ अधातु ऑक्साइड के साथ अभिक्रिया करके लवणीय व जल बनाते हैं
CO2 + Ca(OH)2 → CaCO3 + H2O
उपरोक्त अभिक्रिया से पता चलता है। कि अधातु ऑक्साइड अम्लीय प्रकृति के होते हैं
पीएच (pH)
पीएच का अर्थ हाइड्रोजन आयन प्रदान करने की शक्ति से है।
pH स्केल (pH Scale)
pH स्केल इसका शून्य से 14 तक होता है। तथा 7 इसका मध्य मान उदासीनता को दर्शाता है।
विभिन्न पदार्थो का pH
| क्रo संo | पदार्थ | pH |
| 1. | जूस | 1.2 |
| 2. | जठर रस | 1.5 से 3.5 के मध्य |
| 3. | नीबू का रस | 2.2 |
| 4. | शुद्ध जल | 7.4 |
| 5. | रक्त | 7.4 |
| 6. | चुना पत्थर (CaCO3) | 9.91 |
| 7. | मिल्क ऑफ़ मैग्नीशिया (Mg(OH)2) | 10.0 |
| 8. | चुने का पानी (Ca(OH)2) | 12.4 |
| 9. | सोडियम हाइड्राक्साइड (NaOH) | 14.0 |
पीएच के आधार पर अम्ल और क्षारक को निम्न प्रकार बांट सकते हैं-
प्रबल अम्ल (Strong acid)
यह अधिक मात्रा में H+ आयन देते हैं, इनका पीएच का मान काफी कम होता है। इनका H+ तथा ऋणायन में पूर्णतया अपघटन हो जाता है। जैसे – HCl, H2SO4, HNO3 ,H2CO3
दुर्बल अम्ल (Weak acid)
यह कम मात्रा में H+ आयन देते हैं, इनके पीएच का मान 7 के लगभग होता है। इनका H+ तथा ऋणायन में पूर्णतया अपघटन नहीं हो पाता है। जैसे – एसीटीक अम्ल, सिट्रिक अम्ल
दुर्बल क्षारक (Weak Base)
यह कम सांद्रता में OH– आयन देते हैं। इनका OH– तथा धनायन में पूर्णतया अपघटन नहीं हो पाता है। जैसे – Mg(OH)2 NH4OH
प्रबल क्षारक (Strong Base)
यह अधिक सांद्रता में OH– आयन देते हैं। इनका OH– तथा धनायन में पूर्णतया अपघटन हो जाता है। जैसे –NaOH, KOH
लवण (Salt)
अम्ल तथा क्षारक की अभिक्रिया से प्राप्त यौगिक लवण कहलाते है। जैसे – CaCl2, AlCl3, MgSO4, NaCl, NaNO3, CaCO3, CH3COONa
लवण का निर्माण
2HCl + Ca(OH)2 → CaCl2 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
3HCl + Al(OH)3 → AlCl3 + 3H2O
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
H2SO4+ Mg(OH)2 → MgSO4 + 2H2O
3H2SO4+ 2Al(OH)3 → Al2(SO4)3 + 6H2O
CH3COOH + KOH → CH3COOK + H2O
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Ca(OH)2 → (CH3COO)2Ca + 2H2O
2CH3COOH + Mg(OH)2 → (CH3COO)2Mg + 2H2O
3CH3COOH + Al(OH)3 → (CH3COO)3Al + 3H2O
लवणों की प्रकृति (Properties of Salt)
- प्रबल अम्ल तथा प्रबल क्षारक से बनने वाले लवण उदासीन होते है।
- दुर्बल अम्ल तथा दुर्बल क्षारक से बनने वाले लवण उदासीन होते है।
- प्रबल अम्ल तथा दुर्बल क्षारक से बनने वाले लवण अम्लीय होते है।
- दुर्बल अम्ल तथा प्रबल क्षारक से बनने वाले लवण क्षारकीय होते है।
अम्ल क्षारक एवं लवण
इन्हें भी पढ़े
लेक्चर वीडियों
बाहरी कड़ियाँ
अम्ल क्षारक एवं लवण







