रासायनिक अभिक्रिया के प्रकार
रासायनिक समीकरण (Chemical Equation)
किसी रासायनिक अभिक्रिया में काम आने वाले तत्व अथवा यौगिकों को उनके प्रतीक चिन्हों के रूप में दर्शाना रासायनिक समीकरण कहलाता है।
रासायनिक समीकरण के निम्नलिखित अवयव होते हैं-
- अभिकारक
- उत्पाद
अभिकारक (Reactant)
अभिक्रिया में भाग लेने वाले तत्व अभिकारक कहलाते हैं।
उत्पाद (Product)
अभिक्रिया के दौरान बनने वाले तत्व अथवा यौगिक उत्पाद कहलाते हैं।
उत्प्रेरक (Catalyst)
यह अभिक्रिया के वेग को परिवर्तित करने में सहायता करते हैं।
रासायनिक अभिक्रिया के प्रकार
रासायनिक अभिक्रिया चार भागों में बांटा जाता है-
संयोजन अभिक्रिया (Addition Reaction)
दो या दो से अधिक अभिकारक मिलकर एकल उत्पाद का निर्माण करते हैं। संयोजन या संयुग्मन अभिक्रिया कहलाती है।
A+ B → AB
Mg +Cl2 → MgCl2
N2 + 2H3 → 2NH3
C + O2 → CO2
2Cu + O2 → 2Cuo
वियोजन या अपघटन अभिक्रिया (Dissociation Reaction)
वह अभिक्रिया जिसमें एक अभिकारक टूट कर दो या दो से अधिक उत्पाद का निर्माण करता है।
AB → A + B
वियोजन या अपघटन अभिक्रिया कहलाती है। यह तीन प्रकार की होती है-
ऊष्मीय अपघटन या ऊष्मीय वियोजन (Thermal Dissociation)
ऐसी अभिक्रिया जिसमें उष्मा प्रदान करके अभिकारकों को उत्पाद में तोड़ा जाता है, ऊष्मीय वियोजन अभिक्रिया कहलाती है।
CaCO3 → CaO + O2 (गर्म करने पर)
2Pb(NO3)2 → 2PbO + 4NO2 + O2
प्रकाशिक अपघटन या प्रकाशीय वियोजन (Photolytic Dissociation )
ऐसी अभिक्रिया जिनमें अभिकारकों को सूर्य के प्रकाश में रखने पर यह उत्पाद में टूट जाते हैं, प्रकाशीय वियोजन कहलाती हैं।
2AgBr → 2Ag + Br2
2AgCl → 2Ag + Cl2
विद्युत अपघटन या विद्युत वियोजन (Electric Dissociation)
ऐसी अभिक्रिया विद्युत धारा प्रवाहित करने पर अभिकारक उत्पाद में टूट जाते हैं।
2H2O → 2H2 + O2
विस्थापन अभिक्रिया (Displacement Reaction)
ऐसी अभिक्रिया जिनमें अधिक क्रियाशील तत्व कम क्रियाशील तत्व का स्थान ले लेता है, विस्थापन अभिक्रिया कहलाती है।
Ax + B → Bx + A
2HCl + 2K → 2KCl+ H2
6HCl + 2Al → 2AlCl3 + 3H2
2HCl +2Na → 2NaCl + H2
2HCl + Ca → CaCl2 + H2
द्विविस्थापन अभिक्रिया (Double Displacement)
ऐसी अभिक्रिया जिनमें आयनों का आदान-प्रदान होता है, द्विविस्थापन अभिक्रिया कहलाती है।
Ax + By → Bx Ay
2HCl + K2O → 2KCl+ H2O
6HCl + 2Al(OH)3 → 2AlCl3 + 6H2O
2HCl +Na2O → 2NaCl + H2O
2HCl + CaO → CaCl2 + H2O
अभिक्रिया की गति के आधार पर रासायनिक अभिक्रियाओं को दो भागों में बांटा जाता है
मंद अभिक्रिया (Slow Reaction)
ऐसी अभिक्रिया जिसको संपन्न होने में कई वर्ष, महीनों या दिन लग जाते हैं, मंद अभिक्रिया कहलाती है।
जैसे लोहे के जंग लगना
Fe + O2 + H2O → Fe2O3.3H2O
तीव्र अभिक्रिया (Fast Reaction)
ऐसी अभिक्रिया जो कुछ ही सेकंड में संपन्न हो जाती है।
NaOH + HCl → NaCl + H2O
अर्द्ध आयुकाल (Haft Time)
वह समय जिसमें अभिकारकों की आधी मात्रा उत्पाद में बदल जाती है, अर्द्ध आयु काल कहलाती है। जैसे प्रकाश सश्लेष्ण के लिए इसका मान 10-12SEC होता है।
अभिक्रिया की दिशा के आधार पर रासायनिक अभिक्रिया के प्रकार की होती है-
उत्क्रमणीय अभिक्रिया
अनुत्क्रमणीय अभिक्रिया
उत्क्रमणीय अभिक्रिया (Reversible Reaction)
ऐसी अभिक्रिया जो दोनों दिशाओं में संपन्न होती है, अर्थात इनमें अभिकारक से उत्पाद बनते हैं और उत्पाद पुनः अभिकारक का निर्माण कर लेते हैं। यह साम्याव्यवस्था पर सम्मान रूप से चलती है।
N2 + 3H2 ⇌ 2NH3
अनुत्क्रमणीय अभिक्रिया (Irreversible Reaction)
ऐसी अभिक्रिया एक दिशा में ही संपन्न होती है अर्थात अभिकारक उत्पाद बनाते हैं, परंतु उत्पाद पुनः अभिकारकों में परिवर्तित नहीं होते।
ऊष्मा के निष्कासन या अवशोषण के आधार पर अभिक्रिया दो प्रकार की होती है-
ऊष्माक्षेपी अभिक्रिया
ऊष्माशोषी अभिक्रिया
ऊष्माक्षेपी अभिक्रिया (Exothermic Reaction)
ऐसी अभिक्रिया जिसके दौरान ऊष्मा का निष्कासन होता है ऊष्माक्षेपी अभिक्रिया कहलाती है।
C + O2 → CO2 + ऊष्मा
C6H12O6 + 6O2 → 6CO2 + 6H2O + ऊर्जा
ऊष्माशोषी अभिक्रिया (Endothermic Reaction)
ऐसी अभिक्रिया जिसके दौरान ऊष्मा का अवशोषण किया जाता है, ऊष्माशोषी अभिक्रिया कहलाती है।
2HBr → H2 + Br2
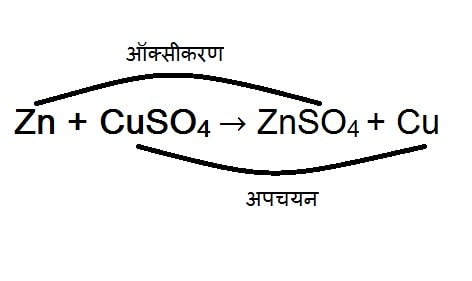
ऑक्सीकरण एवं अपचयन ऑक्सीकरण (Oxidation and Reduction Reaction)
ऑक्सीकरण अभिक्रियाँ
यह निम्न स्थितियों में होती है-
ऑक्सीजन का योग होता है।
2CO + O2 → 2CO2
Cu + O2 → 2CuO
2H2 + O2 → 2H2O
2Mg + O2 → 2MgO
S + O2 → SO2
N2 + O2 → 2NO
CH4 + 2O2 → CO2 + 2H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2PbO2 → 2PbO + O2
हाइड्रोजन का निष्कासन होता है।
H2S + Cl2 → 2HCl + S
CH4 + 2O2 → CO2 + 2H2O
4HI + MnO2 → MnCl2 + 2H2O + Cl2
CH3OH → CH2O + H2
CO + H2 → CH3OH
4HI + O2 → 2H2O + 2I2
धन विद्युत की तत्व का निष्कासन होता है।
2Fe + 3F2 → 2FeF3
Fe+ S → FeS
SnCl2 + Cl2 → SnCl4
ऋण विद्युतीय तत्व का योग होता है।
2KI + Cl2 → 2KCl + I2
इलेक्ट्रॉन का निष्कासन होता है।
Mg → Mg2+ + 2e–
Na → Na+ + e–
Ca → Ca2+ + 2e–
अपचयन अभिक्रियाँ
यह निम्न स्थितियों में होती है-
ऑक्सीजन का निष्कासन होता है।
H2O + C → CO + H2
CuO + C → Cu + CO
Al + Fe2O3 → Fe+ Al2O3
2CO + O2 → 2CO2
हाइड्रोजन का योग होता है। C2H4 + H2 → C2H6
धन विद्युतीय तत्व का योग होता है।
2FeCl3 + H2 → 2FeCl2 + 2HCl
ऋण विद्युतीय तत्व का निष्कासन होता है।
CuCl2 + Cu → Cu2Cl2
इलेक्ट्रॉन का योग होता है।
Cl + e– → Cl–
N + 3e → N3-
रेडोक्स अभिक्रियाँ (Redox Reaction)
अभिक्रिया में ऑक्सीकरण तथा अपचयन दोनों साथ-साथ होता है, तो इसे रेडोक्स अभिक्रियाँ कहते है।
इन्हें भी पढ़े
- Class 10th Chapter 1 Chemical Reaction & Chemical Equation Questions in Hindi
- कार्बन के ऑक्साइड एवं उनकी सामान्य जानकारी (Carbon oxides and their general information)
- का र्बन के भौतिक तथा रासायनिक गुण Physical and chemical properties of carbon
- कार्बन के अपररूप – क्रिस्टलीय एवं अक्रिस्टलीयAppearance of carbon – crystalline and non- crystalline
- उत्प्रेरण एवं उत्प्रेरक (Catalysis and Catalyst Hindi)
बाहरी कड़ियाँ
रासायनिक अभिक्रिया के प्रकार







