कार्बन के अपररूप (Allotropes of Carbon)
प्रकृति में कार्बन विभिन्न रूपों (Form) में पाया जाता है, जिनको कार्बन के अपररूप (Allotropes of Carbon) कहते हैं।
जब एक तत्व दो या अधिक रूपों में पाया जाता है, जिनके गुणधर्म एक-दुसरे से भिन्न होते है तो उस तत्व के इस गुण को अपररूपता (allotropy) तथा विभिन्न रूपों को अपररूप (allotropes) कहते हैं।
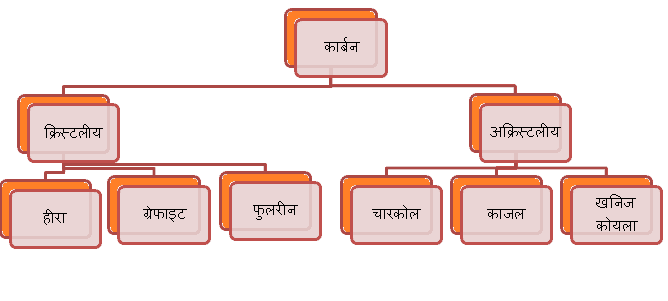
कार्बन के अपररूपों (Allotropes of Carbon) दो भागों में बाँटा गया हैं-
- क्रिस्टलीय कार्बन अपररूप (Crystalline carbon)
- अक्रिस्टलीय कार्बन अपररूप (Non-Crystalline carbon)
कार्बन (Carbon) के विभिन्न अपररूप (Allotropes) को निम्न चार्ट द्वारा प्रदर्शित किया जा सकता है-
कार्बन के क्रिस्टलीय अपररूप (Crystalline Allotropes of Carbon)
(i) हीरा (Diamond)
हीरा कार्बन का शुद्ध रूप (Pure Form) है इनको हीरे की खानों से प्राप्त किया जाता हैं। ये खानें मुख्य रूप से दक्षिण अफ्रीका (South Africa), ब्राजील (Brazil), अमेरिका (America), रूस (Russia) एंव भारत (India) में पाई जाती हैं। विश्व के समस्त हीरों का लगभग 95 प्रतिशत हीरा दक्षिण अफ्रीका से प्राप्त होता है।
भारत में हीरा दक्षिण में गोलकुंडा की खानों में मिलता है। मध्यप्रदेश (Madhay Pradesh) में पन्ना, आंध्रप्रदेश (Andhra Pradesh) में वजरा कारुर में भी हीरे की खानें हैं।
विश्व प्रसिद्ध कोहिनूर (Kohinoor) हीरा गोलकुंडा की खान में से ही निकला गया था।
हीरों का वजन कैरेट में मापा जाता है। एक कैरेट का मान 0.2053 ग्राम होता है।
हीरे के गुण (Properties of Diamond)
- शुद्ध हीरा रंगहीन (Colorless), पारदर्शी (Transparent) तथा सबसे कठोर ठोस है।
- यह विद्युत् तथा ताप का अचालक है।
- इसका आपेक्षिक घनत्व 3.52 तथा अपवर्तनांक 2.45 है।
- यह बहुत ही अक्रियाशील (Non-reactive) पदार्थ है। इसको बहुत अधिक गर्म करने पर जलता है, और केवल कार्बनडाइऑक्साइड (CO2) बनती है।
हीरे की संरचना (Structure of Diamond)
हीरों में केवल कार्बन परमाणु होते हैं, प्रत्येक कार्बन चार अन्य कार्बन परमाणुओं से एकल सहसंयोजक बंधों द्वारा जुड़ा रहता है। इसमें परमाणु SP3 संकरण होता है तथा प्रत्येक कार्बन परमाणु समचतुष्फ़लक (Icosahedral) के केंद्र पर स्थित होता है तथा अन्य चार कार्बन परमाणु समचतुष्फ़लक (Icosahedral) के कोनों पर स्थित होते हैं ।
इस संरचना में सभी C-C बंधों की लम्बाई 1.54A होती है इस प्रकार हीरे की संरचना में प्रबल सहसंयोजक बंधों का त्रिविम जाल रहता है। इसी कारण हीरा अत्यंत कठोर होता है।
हीरे का गलनांक भी उच्च (3843K) होता है। कार्बन के चारों संयोगी इलेक्ट्रॉन बंध में भाग लेते हैं जिसके कारण हीरा विद्युत् का अचालक होता है।
हीरे के उपयोग (Use of diamond)
- हीरा कांच काटने में।
- जवाहारात के रूप में।
- नगों पर पालिश करने में।
- चट्टानों एंव संगमरमर को काटने में।
(ii) ग्रेफाइट (Graphite)
ग्रेफाईट शब्द ग्रेफो (Grapho) से बना है जिसका अर्थ है, लिखना। ग्रेफाइट को प्रारम्भ में सीसे का अपररूप (Allotrope) मान कर प्लुम्बेगो (Plumbago) अथवा कालासीसा कहा गया।
इसीलिए लिखने वाली पेन्सिल को आज भी सीसा पेन्सिल (Lead Pencil) कहा जाता है जबकि पेन्सिल में सीसा नहीं ग्रेफाईट होता है, जो की कार्बन का अपररूप है तथा एक अधातु (Non-Metal) है।
प्रकृति में ग्रेफाईट विस्तृत रूप में मिलता है। अमेरिका (America), इटली (Italy), श्रीलंका (Sri Lanka), साइबेरिया (Siberia), नेपाल (Nepal), कनाडा (Canada), चेकोस्लोवाकिया (Czechoslovakia) और भारत (India) में इसकी खानें हैं।
भारत में इसकी खानें उड़ीसा (Orissa), राजस्थान (Rajasthan), बंगाल (Bangal), कश्मीर (Kashmir) और दक्षिण भारत (South India) में हैं।
ग्रेफाईट के गुण (Properties of Graphite)
ग्रेफाईट गहरे धूसर रंग (Gray Color) का एक नर्म पदार्थ है। यह छुने में चिकना लगता है। इसमें धात्विक चमक (Metallic glow) होती है। यह विद्युत् और ऊष्मा का चालक है।
यह विद्युत् और ऊष्मा का चालक (Conductor) है। यह वायु में 937K ताप पर गर्म करने पर जलने लगता है और कार्बनडाइऑक्साइड गैस निकलती है।
ग्रेफाईट की संरचना (Structure of Graphite)
ग्रेफाइट में प्रत्येक कार्बन परमाणु SP2 संकरण होता है तथा तीन अन्य कार्बन परमाणुओं से एकल संयोजी बंधों द्वारा जुड़ा रहता है। प्रत्येक कार्बन परमाणु का एक इलेक्ट्रॉन मुक्त रहता है जिसके कारण ग्रेफाइट विद्युत् का चालक (Conductor) होता है।
ग्रेफाइट में C-C बंधों की लम्बाई 1.42A होती है। प्रत्येक कार्बन परमाणु अन्य तीन कार्बन परमाणुओं से जुड कर षट्कोणीय वलय बनाकर एक ही तल पर स्थित रहते हैं ।
ग्रेफाइट की ये सभी वलय (Ring) संरचनाए आपस में मिलकर एक परत संरचना बनाती है। दो परतों के मध्य आकर्षण बल दुर्बल (Weak Attraction force) होने के कारण एक परत दूसरी परत पर आसानी से फिसल जाती है। इसीलिए ग्रेफाइट नर्म और चिकना (Soft and smooth) होता है।
ग्रेफाईट के उपयोग (Use of Graphite)
- ग्रेफाइट नर्म और चिकना होने के कारण इसको शुष्क स्नेहक (Dry lubricant) के रूप में।
- क्रुसिबल तथा इलेक्ट्रोड बनाने में।
- लिखने की पेन्सिल बनाने में।
- लोहे की वस्तुओं पर पालिश (Polish) करने के काम में।
(iii) फुलरीन (Fullerenes)
यह कार्बन का क्रिस्टलीय अपररूप है। इसकी खोज सन 1985 में हुई है। फुलरीन के अणु में 60, 70 या अधिक संख्या में कार्बन परमाणु रहते हैं ।
फुलरीन की संरचना (Structure of Fullerene)
फुलरीन के अणुओं की संरचना गोल गुंबद (Round dome) जैसी होती है।
इसीलिए अमेरिका के प्रसिद्ध वास्तुकार बकमिनसटर फुलर के नाम इसका नाम फुलरीन रखा गया। इनमें C60 फुलरीन सबसे ज्यादा स्थायी है। C60 को बकमिन्स्टर फुलरीन कहते हैं ।
फ़ुटबाल के समान आकृति के कारण C60 को बकी वाल भी कहते हैं। C60 की संरचना में 32 फलक होते हैं, जिसमें 20 फलक षट्कोणीय तथा 12 फलक पंचकोणीय हैं।
फुलरीन के गुण (Properties of Fullerene)
कार्बन के तीनों अपररुपों में ग्रेफाइट (Graphite) सबसे अधिक व फुलरीन (Fullerene) से कम स्थायी है।
फुलरीन के उपयोग (Uses of Fullerene)
फुलरीन 60 के क्षार तत्वों के साथ यौगिक उच्च तापीय अतिचालकता प्रदर्शित (High Temprature Superconductivity) करते हैं ।ये यौगिक तकनीकी दृष्टि से अत्यधिक उपयोगी हैं ।
कार्बन के अक्रिस्टलीय अपररूप (Non-crystalline Allotropes of Carbon)
शक्कर को गर्म करके उसमें निहित जल को वाष्पीकृत कर दिया जाए अथवा शक्कर में दो-तीन मिली लीटर सान्द्र सल्फ्यूरिक अम्ल (Conc H2SO4) डालने पर कला पदार्थ अवशेष के रूप में रह जाता है, इसे शर्करा चारकोल (Sugar charcoal) कहते हैं।







