कार्बन के ऑक्साइड (Oxides of Carbon)
कार्बनके ऑक्साइड तीन प्रकार के होते है–
- कार्बन सबऑक्साइड (C3O2)
- कार्बनमोनोऑक्साइड (CO)
- कार्बन डाइऑक्साइड (CO2)
1. कार्बन सबऑक्साइड / Carbon suboxide (C3O2)
मैलोनिक अम्ल के फॉस्फोरसपेंटाक्साइड द्वारा निर्जलीकरण (anhydration) से यह रंगहीन गैस के रूप में बनाता है।
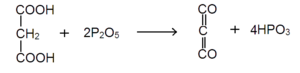
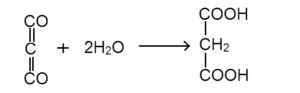
यह तीक्ष्ण गंध (Pungent smell) की रंगहीन विषैली गैस है। वायु में जलाने पर यह धुएंदार नीली ज्वाला से जल कर कार्बनडाइऑक्साइड बनाती है। यह जल से संयोग कर मेलोनिक अम्ल (Malonic acid) बनाती है।
2. कार्बन मोनोऑक्साइड / Carbon monoxide (CO)
कार्बन को ऑक्सीजन की सीमित मात्र में जलाने पर कार्बन मोनोऑक्साइड (CO) गैस बनाती है।
2C + O2 → 2CO
फार्मिक अम्ल (मेथेनोइक अम्ल) को सान्द्र सल्फ्युरिक अम्ल (Concentrated sulfuric acid) के साथ गर्म करने पर कार्बन मोनोऑक्साइड बनाती है।
HCOOH → H2O + CO (H2SO4 की उपस्थिति में)
यह रंगहीन, गंधहीन तथा विषैली गैस है।
इसका गलनांक (Melting point) 68K तथा क्वथनांक (Boiling point) 8.15K होता है। यह जल में कम विलेय है।
कार्बन मोनोऑक्साइड गैस की विषैली प्रकृति (The toxic nature of carbon monoxide gas)
यह गैस रक्त के पाए जाने वाले हिमोग्लोबिन से जुड़कर होकर कार्बोक्सी हिमोग्लोबिन (Carboxy hemoglobin) बनाती है, जिससे हिमोग्लोबिन ऑक्सीजन से नहीं जुड़ सकता तथा यह ऑक्सीजन वाहक (Oxygen carrier) का कार्य नहीं कर सकता है। धीरे-धीरे रक्त की ऑक्सीजन ले जाने की क्षमता (Capacity) नष्ट हो जाती है एंव मनुष्य दम घुटने के कारण मर जाता है।
यदि 800 आयतन वायु में एक आयतन कार्बन मोनोऑक्साइड मिली हो तो इसमें साँस लेने से 30 मिनट में मृत्यु हो जायेगी ।
कमरे में अंगीठी जला कर सोने से कार्बन मोनोऑक्साइड (CO) द्वारा मनुष्य की मृत्यु हो जाती हैं ।
यदि कोई व्यक्ति CO से बेहोश हो जाता हे तो उसे खुले में ले जाकर 95% O2 तथा 5% CO2 मिश्रण का कृत्रिम श्वसन दिया जाना चाहिए।
कार्बन मोनोऑक्साइड का उपयोग (Use of carbon monoxide)
(i) CO तथा N2 के मिश्रण को प्रोड्यूसर गैस कहते है। जो एक ज्वलनशील गैस है जिसका उपयोग ईंधन के रूप में होता है।
(ii) CO तथा H2 के मिश्रण को भाप अंगार या जल गैस कहते है। जिसका उपयोग ईंधन के रूप में होता है।
(iii) रंजक उद्योग में इसका उपयोग किया जाता है।
(iv) युद्ध कार्य में काम आने वाली फास्जीन गैस (COCl2) के निर्माण में उपयोग किया जाता है।
(v) धातु निष्कर्षण में अपचायक (Reducing agent) के रूप में इसका उपयोग किया जाता है।
(vi) मेथेनाल तथा संश्लेषित पेट्रोल (Synthetic petrol) के निर्माण में।
(vii) निकल धातु के निष्क्रष्ण में।
कार्बन के ऑक्साइड
3. कार्बन डाइऑक्साइड / Carbon dioxide (CO2)
यह सामान्तया सबसे अधिक पाया जाने वाला कार्बन के ऑक्साइड में से है। यह वायु में आयतन के अनुसार लगभग 0.03 प्रतिशत उपस्थित होती है। यह गुफाओं, खानों या चूने के भट्टों के निकट अथवा शुष्क कुओं में पाई जाती हैं।
कार्बन डाइऑक्साइड दहन (Combustion), श्वसन (respiration) एंव किण्वन (fermentation) की क्रियाओं में भी बनती है।
कार्बन डाइऑक्साइड को प्राप्त करने की विधि (Method of obtaining carbon dioxide)
प्रयोगशाला में संगमरम के टुकड़ों पर तनु हाइड्रोक्लोरिक अम्ल (Dilute hydrochloric acid) की अभिक्रिया द्वारा बनाई जाती है।
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
चूने के निर्माण में चूने के भट्टों में चूने के पत्थर (Limestone) को गर्म करके कार्बन डाइऑक्साइड प्राप्त होती है।
CaCO3 + 2HCl → CaO + CO2
कार्बन डाइऑक्साइड के भौतिक गुण (Physical Properties of Carbon Dioxide)
कार्बन डाइऑक्साइड रंगहीन , गंधहीन गैस है। यह जल में विलेय (soluble) है तथा जलीय विलयन नीले लिटमस पत्र को लाल कर देता है। अत: अम्लीय प्रकृति की है।
यह वायु की अपेक्षा 1.5 गुना भरी है। यह विषैली नहीं है। इसे कम ताप एंव उच्च दाब पर संपीडित करके द्रव रूप में बदला जा सकता है जिसका क्वथनांक ग्लांक 216.4K होता है। ठोस कार्बनडाइऑक्साइड शुष्क बर्फ (dry ice ) के रूप में जनि जाती है।
कार्बन डाइऑक्साइड के रासायनिक गुण (Chemical Properties of Carbon Dioxide)
(i) CO2 अत्यन्त अथायी है फिर भी जलता हुए मैग्नीशियम तार को CO2 से भरे गैस जार में ले जाने पर वह जलता रहता है एंव कार्बन पृथक हो जाता है।
2Mg + CO2 → 2MgO + C
(ii) कार्बनडाइऑक्साइड को चूने के पानी में प्रवाहित करने पर चूने का पानी अविलेय कैल्सियम कार्बोनेट बनने के कारण दुधिया हो जाता है।
Ca(OH)2 + CO2 → CaCO3 + H2O
(iii) CO2 गैस को चूने के पानी में अधिक समय तक प्रवाहित करने पर विलेय कैल्सियम बाईकार्बोनेट बनने के कारण दुधियापन समाप्त हो जाता है।
CaCO3 + H2O + CO2 → Ca(HCO3)2
कार्बनडाइऑक्साइड के उपयोग (Uses of carbon dioxide)
(अ) आग बुझाने में ।
(ब) प्रकाश संश्लेषण की क्रिया में पोधे CO2 ग्रहण करते हैं ।
(स) सोडियम कार्बोनेट (Na2CO3) , सोडा वाटर आदि के निर्माण में ।
(द) शुष्क बर्फ (ठोस CO2) का उपयोग प्रशीतक के रूप में।
रसायन विज्ञान के नोट्स के क्लिक करे – Click here
वेबसाइट बनाना सीखे क्लिक करे – Click here








Keep this going please, great job!
Keep this going please, great job!