ऑक्सीजन का सामान्य परिचय (General Introduction of Oxygen)
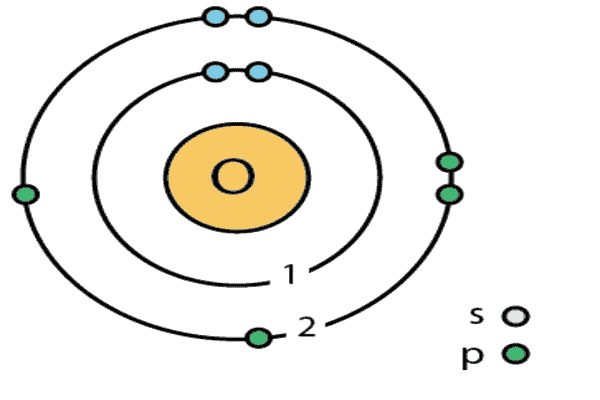
ऑक्सीजन p ब्लॉक तत्वों में सम्मिलित है यह आवर्त सारणी के 16वें वर्ग का प्रथम तत्व है। इसका इलेक्ट्रोनिक विन्यास 1s2, 2s2 2p4 होता है। इसकी संयोजकता -2 तथा परमाणु द्रव्यमान 16 होता है।
प्रकृति में ऑक्सीजन (Oxygen in Nature)
यह वायुमण्डल में मुक्त अवस्था (Free state) में आयतन की दृष्टि से लगभग 21% पाई जाती है।
संयुक्त अवस्था में भार की दृष्टि से जल में 89% धरातल में 50% जन्तु तथा वनस्पति में 50-70% भाग ऑक्सीजन होती है।
ऑक्सीजन की प्राप्ति (Attainment of Oxygen)
ऑक्सीजन का अणु द्विपरमाणु (Two atoms) है अत: इसे डाइऑक्सीजन भी कहा जाता है।
प्रयोगशाला (Laboratory) में सामान्यतया दो विधियों से ऑक्सीजन गैस बनाई जा सकती है–
- गर्म विधि
- ठण्डी विधि
(1) ऑक्सीजन प्राप्त करने की गर्म विधि (Hot method of obtaining oxygen)
KMnO4, KClO3 अथवा Pb(NO3)2 आदि यौगिकों में ऑक्सीजन की उच्च प्रतिशत होती है इन यौगिकों के ताप अपघटन द्वारा ऑक्सीजन गैस प्राप्त की जाती हैं।
उदाहरण
पोटैशियम क्लोरेट (KClO3) को 900K ताप पर उत्प्रेरक की अनुपस्थिति में तथा 633K ताप पर मैंग्नीज डाइ ऑक्साइड (MnO2) उत्प्रेरक की उपस्थिति में गर्म करके ऑक्सीजन गैस प्राप्त करते है।
2KClO3 → 2KCl + 3O2
इस अभिक्रिया में क्रियाकारकों को गर्म किया जाता हैं अत: इसे गर्म विधि (Hot method) कहते हैं।
प्रयोग (Expriment)
एक कठोर कांच की नली में पोटैशियम क्लोरेट (KClO3) तथा मैंग्नीज डाइ ऑक्साइड (MnO2) को 5:1 के अनुपात में मिश्रण लेकर सावधानिपुर्वक गर्म करते हैं। जिससे ऑक्सीजन गैस बनती है
निकलने वाली गैस को एक जार में नलिका द्वारा एकत्र करते है जब जार गैस से भर जाता है तो उससे O2 गैस प्राप्त क्र लेते है।
सावधानियां (Precautions)
(i) उपकरण पूर्णतया वायुरोधक होना चाहिए ।
(ii) शुरू में बनी गैस को इकट्ठी नहीं करना चाहिए क्योंकि इसके साथ परखनली व् निकासनली की वायु भी मिश्रित रहती है।
(iii) प्रयोग की समाप्ति पर निकास्न्ली को द्रोणिक से बाहर निकाल कर बर्नर हटाना चाहिए ।
(iv) MnO2 पूर्णतः शुद्ध होनी चाहिए। उसमें कार्बन के कणों की अशुद्धि होने से विस्फोट होने का खतरा भी रहता हैं।
(2) ऑक्सीजन प्राप्त करने की ठण्डी विधि (Cold method of obtaining oxygen)
सोडियम परोक्साइड पर जल (H2O) की अभिक्रिया कराने पर ऑक्सीजन गैस बनती है।
2Na2O2 + H2O → 4NaOH + O2
इस अभिक्रिया में क्रियाकारकों को गर्म नहीं किया जाता हैं अत: इसे ठण्डी विधि (Cold method) कहते हैं ।
प्रयोग (Expriment)
चपटे पेंदे के फ्लास्क में थोडा सा सोडियम परोक्साइड (Sodium peroxide) लेकर उसके मुंह पर दो छिद्र वाला कार्क के एक छिद्र में बिन्दुपाती कीप तथा दुसरे छिद्र में निकास नली लगा दी जाती हैं।
निकास नली (Exhaust pipe) का दूसरा सिरा एक जार में खुलता है यह जार मोम से बनी प्लेट पर रखा होता है, जो पानी से भरे पात्र में रखा होता हैं।
बिन्दुपाती कीप (thistle funnel) से आवश्यकतानुसार बून्द-बून्द करके जल को फ्लास्क में डालते हैं।
2Na2O2 + H2O → 4NaOH + O2
जल सोडियम परोक्साइड (Sodium peroxide) से अभिक्रिया कर ऑक्सीजन गैस बनाता है जिसे जल के अधोमुखी विस्थापन (Downward shift) द्वारा गैस जार में एकत्रित कर लिया जाता है।
ऑक्सीजन का औद्योगिक निर्माण (Industrial manufacture of oxygen)
(i) जल के विद्युत अपघटन द्वारा (By electrolysis of water)
हॉफमैन वोल्टामीटर (Hofmann voltameter) में अम्लीकृत जल लेकर उसमें विद्युत धारा प्रवाहित करने पर एनोड पर एक आयतन ऑक्सीजन तथा कैथोड पर दो आयतन हाइड्रोजन प्राप्त होती हैं।
2H2O → 2H2 + O2
इसे निम्न प्रकार व्यक्त कर सकते है-
2H2O → 2H+ + 2OH–
एनोड पर – 2OH– → 2OH + 2e–
2OH + 2OH → 2H2O + O2
कैथोड पर – 2H+ + 2e– → H2
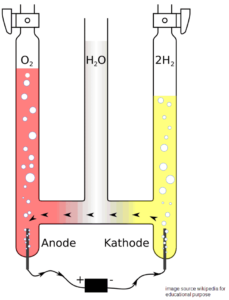
इस विधि से ऑक्सीजन (O2) तथा हाइड्रोजन (H2) दोनों प्राप्त की जाती हैं।
(ii) वायु से ऑक्सीजन की प्राप्ति (Obtaining oxygen from air)
वायु से ऑक्सीजन दो प्रकार से प्राप्त होती हैं –
- भौतिक विधि
- रासायनिक विधि
(1) भौतिक विधि (Physical method)
इसे लिंडे प्रक्रम (Linde process) के नाम से जाना जाता है। द्रव वायु के प्रभाजी वाष्पन करने पर उसमें उपस्थित नाइट्रोजन (77.2K ताप पर) पहले गैसीय अवस्था में प्राप्त होती हैं इसके पश्चात ऑक्सीजन गैस जिसका क्वथनांक 99.5K होता है प्राप्त होती हैं ।
(2) रासायनिक विधि (Chemical method)
इसे ब्रिन की विधि (Brin’s method) कहा जाता हैं। इस विधि में बेरियम मोनो ओक्साइड (BaO) को वायु में 773K ताप पर गर्म करने से बेरियम परोक्साइड बन जाता है जो अधिक गर्म करने पर ऑक्सीजन (O2) को मुक्त कर देता है।
2BaO + O2 → 2BaO2
2BaO → 2BaO + O2
इस प्रक्रिया को बार-बार करने पर अधिक मात्रा में ऑक्सीजन (O2) प्राप्त हो जाती हैं।
ऑक्सीजन के भौतिक गुण (Physical Properties of Oxygen)
(1) ऑक्सीजन रंगहीन ,गंधहीन, जल में अल्पविलेय गैस हैं। 303K ताप पर जल में इसकी विलेयता लगभग 3 घन मी.प्रति 100 घन मी. हैं। इसी विलेय ऑक्सीजन के कारण जलीय जन्तु (Aquatic animals) जल में जीवित रहते हैं।
(2) इसका जलीय विलयन लिटमस के प्रति उदासीन (neutral) हैं ।
(3) द्रव ऑक्सीजन का रंग हल्का नीला होता है जिसका क्वथनांक 90.5K हैं। ठोस अवस्था में इसका गलनांक 55K है।
(4) डाइऑक्सीजन O2 में एक द्वि सहसंयोजी बंध (Covalent bond) होता है तथा अणु में इलेक्ट्रॉन समसंख्या (Even number) में होते हैं ।
(5) ऑक्सीजन गैस से भरे जार में जलती हुई तीली (Burning stick) ले जाने पर वह तेजी से जलने लगती है अत: गैस जलने में सहायक है किन्तु स्वंय नहीं जलती है।
(6) ऑक्सीजन का अणु अनुचुम्बकीय गुण (Paramagnetic properties) भी प्रदर्शित करता हैं। जो इसमें अयुग्मित इलेक्ट्रानों की उपस्थिति को दर्शाता है। अर्थात ऑक्सीजन में सहसंयोजी बंध के अलावा तीन इलेक्ट्रॉन वाला बंध भी होता हैं जिससे दो इलेक्ट्रॉन अयुग्मित (Unpaired) रह जाते हैं।
ऑक्सीजन के रासायनिक गुण (Chemical Properties of Oxygen)
फ्लूओरिन के बाद ऑक्सीजन सर्वाधिक विद्युत ऋणी तत्व (Electronagetive element) हैं। इसकी विद्युत ऋणता ((Electronagetivity) 3.5 है। अतः यह प्रबल ऑक्सीकारक (Strong oxidizer) है और लगभग सभी तत्वों से क्रिया कर उसके ऑक्साइड बनाती हैं। केवल फ्लूओरिन के साथ ऑक्सीजन फ्लूओरइड (OF2) यौगिक बनाती हैं।
(1) धातुओं से अभिक्रिया (Reaction to Metals)
उच्च ताप पर धातुएँ ऑक्सीजन के साथ अभिक्रिया करके धातुऑक्साइड (metal oxide )बनाती है। ये ऑक्साइड क्षारीय प्रकृति के होते हैं।
2Ca + O2 → 2CaO
2Mg + O2 → 2MgO
4Al + 3O2 → 2Al2O3
4Na + O2 → 2Na2O
4K + O2 → 2K2O
हल्की धातुएँ पराक्साइड भी बनाती हैं।
2Na2O + O2 → 2Na2O2
2K2O + O2 → 2K2O2
2Li2O + O2 → 2Li2O2
(2) अधातुओं से अभिक्रिया (Reaction with non-metals)
अधातुएँ ऑक्सीजन में जलकर उनके ऑक्साइड बनाती हैं।
2H2 + O2 → 2H2O
S + O2 → SO2
C + O2 → CO2
P4 + 5O2 → 2P2O5
Si + O2 → SiO2
अधातुओं के ऑक्साइड प्राय: अम्लीय होते हैं।
(3) अमोनिया से अभिक्रिया (Reaction with ammonia)
रक्त तप्त प्लेटिनम की जाली पर 1073K ताप पर अमोनिया और ऑक्सीजन का मिश्रण प्रवाहित करने पर नाइट्रीक ऑक्साइड गैस बनती हैं।
4NH3 + O2 → 4NO + 6H2O
(4) नाइट्रिक ऑक्साइड से अभिक्रिया (Reaction with nitric oxide)
गैस ऑक्सीजन से संयुक्त होकर लाल भूरे रंग की नाइट्रोजन डाइऑक्साइड (NO2) गैस बनाती हैं।
2NO + O2 → 2NO2
(5) लवणों का ऑक्सीकरण (Oxidation of salts)
अम्लीय माध्यम (Acidic medium) में फेरस सल्फेट को फैरिक सल्फेट में तथा स्टेनस क्लोराइड को स्टेनिक क्लोराइड में ऑक्सीकृत कर देती हैं।
4FeSO4 + 2H2SO4 + O2 → 2Fe2(SO4) + 2H2O
2SnCl2 + 4HCl + O2 → 2SnCl4 + 2H2O
(6) क्यूप्रिक क्लोराइड की उपस्थिति में ऑक्सीजन (O2), हाइड्रोक्लोरिक गैस (HCl) से अभिक्रिया करके क्लोरीन गैस बनाती हैं ।
4HCl + O2 → 2H2O + 2Cl2
(7) 723K ताप पर प्लेटिनम की जाली अथवा वैनेडियम पेंटाक्साइड उत्प्रेरक की उपस्थिति में सल्फर डाइऑक्साइड के साथ ऑक्सीजन अभिक्रिया करके सल्फर ट्राइ ऑक्साइड बनती हैं ।
2SO2 + O2 → 2SO3
सम्पर्क विधि से H2SO4 के निर्माण में यही अभिक्रिया होती हैं।
इन्हें भी पढ़े
बाहरी कड़ियाँ
Learn making website –
What is a website? Definition of website







